что такое пви в медицине в гинекологии расшифровка
Клиника женского здоровья
Папилломавирусная инфекция (ПВИ) занимает особое место среди заболеваний, передаваемых половым путем. Это объясняется высокой заразностью вирусов папилломы человека (ВПЧ), их широкой распространенностью, а также доказанной способностью вызывать рак. Этот вирус является основной причиной развития рака шейки матки, вульвы, влагалища, рака аногенитальной области, а также рака полового члена. Этот вирус также причастен к развитию папилломатоза гортани у детей и самопроизвольному прерыванию беременности.
ВПЧ относится к ДНК-содержащим вирусам. Он поражает кожу и слизистые оболочки и способен длительное время находиться в эпителии половых путей, что обусловливает высокую частоту рецидивирования инфекции. В настоящее время выявлено более 140 типов вируса папилломы, каждый из которых обладает определенными свойствами. Наиболее онкогенными принято считать вирусы типов 16 и 18, которые часто выявляют при злокачественных поражениях шейки матки.
Папилломавирусная инфекция (ПВИ) гениталий относится к инфекциям, передаваемым половым путем. Через 3 года после начала половой жизни более 70% молодых женщин заражаются ВПЧ. Однако уже через 1 год ВПЧ выявляется только у 30% женщин, а через 2 года – всего лишь у 9%. Длительное нахождения ВПЧ в организме (персистенция) приводит к неблагоприятным последствиям, таким как развитие предрака и рака.
С чем же это связано, что у одних женщин ВПЧ остается и вызывает развитие предрака и рака, а у других – полностью элиминируется?
Оказывается, что решающим фактором является состояние иммунной системы. Если иммунитет снижен, у ВПЧ есть все шансы встроиться в ДНК клетки и привести к серьезным изменениям шейки матки. Напротив, при восстановлении нарушенных механизмов – обратное развитие может произойти на любом этапе канцерогенеза.
В развитии ПВИ можно выделить два этапа:
— продуктивный (субклинический) – в это время происходит активное размножение вируса и увеличение числа его копий. Появляются изменения в цитологии – изменяется состояние отдельных клеток эпителия, определяются койлоциты.
— далее идет стадия клинических проявлений – ВПЧ уже встраивается в ДНК клетки. Начинает видоизменяться эпителий, что проявляется дисплазией с последующим развитием в рак.
Факторы риска развития ВПЧ-инфекции
— сексуальная активность (раннее начало половой жизни, большое количество партнеров, частые половые контакты);
— наличие партнеров, имевших контакты с женщиной, болеющей раком шейки матки и аногенитальными кондиломами;
-наличие других ИППП (хламидиоз, гонорея, трихомониаз, сифилис, вирус простого герпеса);
— эндогенные факторы (авитаминоз, изменение иммунного статуса).
Клинические проявления папилломавирусной инфекции
Инкубационный период точно определить сложно: по разным данным – он составляет от 1 до 8 месяцев.
У большинства пациенток инфекция транзиторная и выведение вируса из организма происходит самостоятельно, без последствий. Длительная персистенция ВПЧ инфекции может иметь неблагоприятные последствия.
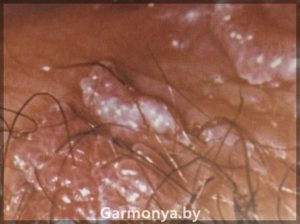
— экзофитная форма ПВИ известна с давних пор и представлена остроконечными кондиломами, являющимися наиболее характерным проявлением ПВИ. С течением времени взгляды на природу остроконечных кондилом подверглись значительной эволюции. Среди причинных факторов даже фигурировали такие заболевания, как трихомониаз, сифилис, гонорея, кандидоз, прием антибиотиков и сульфаниламидов.
Остроконечные кондиломы представляют собой образования на поверхности кожи и слизистых на тонкой ножке, реже — на широком основании в виде одиночного узелка, либо в форме множественных выростов, напоминающих цветную капусту или петушиные гребни.
Локализация генитальных кондилом может быть различной. В первую очередь это малые половые губы, влагалище, шейка матки, устье уретры, клитор, область ануса, а также прилегающие кожные покровы. Инкубационный период колеблется от 1 до 12 мес, составляя в среднем 3 мес. Остроконечные кондиломы, в том числе и аногенитальной области, традиционно успешно лечат дерматологи либо онкологи.
Исследования последних десятилетий свидетельствуют о том, что остроконечные кондиломы представляют собой лишь часть возможного спектра проявлений ВПЧ-инфекции. У 85% пациенток с типичными кондиломами наружных половых органов при обследовании выявляются дополнительные очаги ВПЧ-инфекции влагалища и шейки матки, а из них — почти у каждой четвертой – предраковые изменения.
— эндофитные кондиломы или плоские кондиломы. Они обычно располагаются в толще эпителия и практически не видны невооруженным глазом. Такие изменения может увидеть только специалист при кольпоскопии. Озлокачествление плоских кондилом развивается у 4 — 10% женщин в течение 2 лет, тогда как озлокачествление обычной кондиломы наблюдается в течение 5 лет.
Таким образом, все пациенки, страдающие остроконечными кондиломами аногенитальной области, должны проходить кольпоскопический и цитологический скрининг.
— Дисплазия (предрак) и рак шейки матки, вульвы, влагалища. В развитии дисплазии выделяют несколько степеней – легкая, средняя, тяжелая. Иногда можно выявить поражения всех степеней, тогда диагноз ставится по самой тяжелой степени. Важно сказать следующее – при дисплазии шейки матки легкой степени регресс наблюдается в 57 %, прогресс – в 11%, а развитие инвазивного рака происходит только в 1% случаев. В тоже время при выявлении дисплазии тяжелой степени переход в рак происходит уже в 12 % случаев. Поэтому так важна своевременная диагностика и лечения изменений на шейке матки.
Для диагностики ПВИ применяют различные методы, основные из них:
— визуальный метод (выявление кондилом, папиллом и др. при осмотре);
— ПЦР или Digene-тест (выявляет ДНК возбудителя и определяет вирусную нагрузку);
-цитологический метод – это скрининг рака шейки матки — проводится ежегодно всем женщинам, живущим половой жизнью.
— расширенная кольпоскопия (осмотр шейки матки, вульвы, влагалища под увеличением с проведением специальных тестов, которые помогают выявить специфические изменения);
— при обнаружении измененных участков на шейке матке, вульве, влагалище проводится – биопсия — отщипывается кусочек и отправляется на гистологическое исследование, где врач — лаборант ставит заключительный диагноз;
Лечение:
ПВИ относится к инфекциям, передаваемым половым путем. Поэтому необходимо обследовать и лечить обоих партнеров, а на период терапии и в течение 6 мес после нее целесообразно рекомендовать барьерную контрацепцию с помощью презерватива.
Лечение папилломовтрусной инфекции проводится, учитывая вирусную нагрузку, локализацию, характер процесса (наличие или отсутствие дисплазии) и с учетом сопутствующих заболеваний. При наличии других ИППП следует провести лечение с учетом выявленного возбудителя, а при нарушении микробиоценоза влагалища должна быть осуществлена его коррекция.
Все виды лечения должны быть направлены на удаление измененного эпителия. Для этих целей используются различные виды химических коагулянтов, физиохирургических методов, таких как крио-, электро- и лазеротерапия, а также хирургическое иссечение.
Однако даже при наличии такого большого выбора методов терапии частота рецидивов ПВИ остается высокой. Поэтому не вызывает сомнения необходимость проведения комплексного лечения, включающие системные иммуномодуляторы (панавир, гроприносин, аллокин-альфа и др.). Указанные препараты назначаются только специалистом с учетов показаний и противопоказаний. Не следует использовать данные препараты для самостоятельного лечение.
Кондиломы во время беременности
Во время беременности часто наблюдается значительное увеличение кондилом, которые после родов нередко претерпевают обратное развитие. Образования больших размеров могут служить причиной обструктивных и геморрагических осложнений во время родов, а также увеличивать риск инфицирования плода с развитием в последующем папилломатоза гортани и других органов. Учитывая вышесказанное, целесообразно проведение активного лечения ПВИ у беременных женщин. При этом преимущество отдается криотерапии, солкодерму и трихлоруксусной кислоте. Возможно использование лазеротерапии, электрохирургии и хирургического методов. Лечение целесообразно проводить в ранние сроки беременности. Необходимо помнить, что многие противовирусные препараты противопоказаны во время беременности.
Вопрос о необходимости родоразрешения путем кесарева сечения решается индивидуально. Это связано с тем, что проведение операции не предотвращает инфицирования плода, о чем свидетельствуют случаи развития папилломатоза гортани у детей, рожденных путем кесарева сечения.
В заключение, важно сказать следующее: ВПЧ – это не приговор, это время активных действия и пристального наблюдения. От внедрения папилломовирусов до развития рака шейки матки проходят года и десятилетия. Не зря говорят, что развившийся рак шейки матки – это время упущенных возможностей, то есть на стадии предрака есть возможность сохранить орган, а также менструальную, репродуктивную функцию и самое главное, жизнь пациентке.
Папилломавирусная инфекция в гинекологии.
Проанализировав частые вопросы наших пациентов и актуальность проблемы роста заболеваемости ВПЧ ассоциированных заболеваний, предлагаем Вам, дорогие посетители нашего сайта, информацию о папилломавирусной инфекции (ПВИ).
ПАПИЛЛОМАВИРУСНАЯ ИНФЕКЦИЯ — БИЧ ХХI века.
Вирус папилломы человека (ВПЧ) не является нормальным представителем биотопа влагалища и относится к патогенным микроорганизмам. Установлено, что существует более 150 типов папилломавирусов, и около 40 типов могут инфицировать слизистую половых органов. На сегодняшний день заболевание вирусом папилломы — одна из самых распространенных проблем, как в гинекологии, так и в урологии.
Каждый тип ВПЧ воздействует на свою ткань, т.е. обладает типом и тканеспецифичностью. Именно от типа вируса зависит течение и симптомы заболевания.
Вирус папилломы человека провоцирует ряд гинекологических заболеваний: урогенитальные кондиломы, хронические цервициты, дисплазии вульвы, влагалища, шейки матки. К тому же, папилломавирусы могут вызвать рак шейки матки, рак вульвы и влагалища. Однако не всегда наличие вируса папилломы ведет к развитию этих опасных заболеваний, огромную роль играет общее состояние защитных механизмов организма, наличие различного рода гинекологических и соматических заболеваний, уровень вирусной нагрузки и тип папилломавируса.

В большинстве случаев ВПЧ передается половым путем. При этом, использование презервативов снижает, но полностью не исключает угрозу заражения данной инфекцией.
При профилактических гинекологических осмотрах не проводится специфического анализа на ВПЧ в государственных органах здравоохранения.
Врач может заподозрить наличие ВПЧ-инфекции по результатам онкоцитологического исследования. Тогда для выявления вируса папилломы рекомендуется проводить специальное обследование методом полимеразной цепной реакции (ПЦР). При данном исследовании определяется наличие папилломавирусов, устанавливается их тип.
Обследование на ВПЧ рекомендуется проходить всем женщинам, особенно при наличии эрозии шейки матки, цервицита, аногенитальных кондилом, папиллом, при изменении в онкоцитологическом мазке, при смене полового партнера, специфическом зуде наружных половых органов и исключении кандидоза и половых инфекций.
Нужно ли лечить партнера? Обследовать — да. При наличии ВПЧ лечение проводится совместно с половым партнером, несмотря на то, что для мужчин данная инфекция не представляет такого серьезного риска, как для женщин. Это уменьшает вероятность реинфекции, обуславливает успешность лечения.
Какие типы ВПЧ встречаются?
По данным масштабного скринингового исследования Lorincz I и соавт. установлены наиболее часто встречаемые типы ПВИ гениталий, которые распределены в группы низкого, среднего и высокого онкогенного риска:
-Низкого онкогенного риска: с 42 по 44, 6 и 11 типы;
-Среднего риска: 31 и 33, 51 и 35, 52 и 58 типы;
-Высокого риска: 16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 68, 73, 82 типы.
Период инкубации
Инкубационный период папилломовирусной инфекции может варьироваться от нескольких недель до нескольких лет.
ВПЧ может иметь латентный характер, т. е. протекать без видимых симптомов.
Большой процент заразившихся, особенно молодых женщин (от 60 до 90%), склонны к самоизлечению за 6-12 месяцев. У других заболевание может переходить в хроническую форму с вероятным развитием злокачественных процессов.
За всю свою жизнь человек инфицируется несколькими типами ВПЧ. Определенные факторы пробуждают активность ВПЧ, и тогда болезнь переходит в фазу клинических проявлений.
Период клинических проявлений: по ряду причин после латентного периода в геноме ДНК выполняется реализация закодированной информации, и клетки эпителия начинают делиться. В этот период пациентки могут предъявлять жалобы на усиление белей, зуд, визуализацию клинических признаков заболевания, например, появление кондилом и папиллом. Появляются и констатируются врачом гинекологом кольпоскопические и / или вульвоскопические признаки заболеваний. В помощь врачу является цитология из шейки матки и ПЦР исследования на ВПЧ и сопутствующие половые инфекции.
Пути заражения и передачи папилломавирусной инфекции
Наиболее возможным путем передачи ВПЧ является прямой контакт кожных покровов или слизистых оболочек. Вероятность заражения вирусом напрямую обусловлена количеством половых партнеров: при одном партнере у женщин возбудитель обнаруживается в 17-21% случаев, при 5 партнерах — в 70-80% случаев.
— Традиционный половой контакт — основной путь инфицирования, а папилломавирусная инфекция является инфекцией, передаваемой половым путем.
— Нетрадиционный половой контакт: заражение партнеров возможно также при нетрадиционных контактах (гомосексуальный, аногенитальный, оральный).
-Возможен контактный путь передачи (прикосновениях, генитальные ласки).
-Контактно — бытовой путь: через предметы личного пользования (полотенца, мочалки), в общественных местах (бани, бассейны, душевые).
-Вертикальный путь — возможно заражение во время родов через естественные родовые пути от матери ребенку (при наличии кондилломатоза половых путей у роженицы и активности вируса папилломы человека). В таких ситуациях у детей возможно развитие вестибулярного папилломатоза гортани. Согласно статистических данных риск заражения ребенка составляет менее 3%.
-Имеются случаи инфицирования врачей, медицинского персонала, производящего лазерное и радиоволновое лечение у больных с ВПЧ, с последующим развитием у них папилломатоза конъюнктивы и гортани.
По результатам IARC (2014 г.), в 98% случаев заболеваний рака шейки матки в мире обнаруживаются всего 13 типов ВПЧ. Наиболее опасными (67-93% случаев рака) являются вирусы типов 16 и 18.
Появление остроконечных кондилом и папиллом на слизистой ротоглотки, слизистой шейки матки, прямой кишки вызвано папилломовирусами 6 и 11, 16 и 13, 18, 33 и 31 типов, а также 35 типом.
Факторы риска заражения и развития заболевания
— ранняя половая активность;
— многочисленные половые партнеры;
— наличие сопутствующих скрытых половых инфекций;
— хронические воспалительные процессы органов малого таза;
— частые аборты, травматизация шейки матки;
— нарушение микробиоценоза влагалища;
Контингент женщин для обследования на ВПЧ
— женщины с большим количеством (более 5) половых партнеров и рано начавшие сексуальную активность;
— женщины с жалобами на бели, зуд в интимной зоне;
— женщины с любого рода образованиями шейки матки;
— женщины с кондиломами и папилломами на наружных половых органах;
— женщины, имеющие факторы риска ПВИ;
— женщины, имеющие половых партнеров с ВПЧ.
Формы заболевания
Разные формы вируса вызывают следующие клинические формы:
-генитальные кондиломы; 
-Дисплазия шейки матки, вульварная, цервикальная, влагалищная дисплазия;
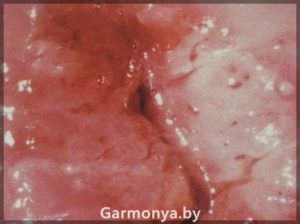
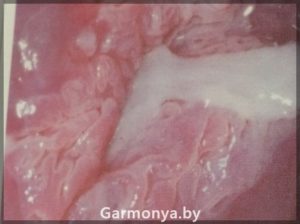
-рак шейки матки; 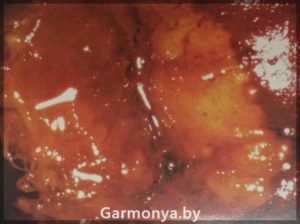
-опухоли влагалища и перианальной области (карцинома, вызванная 45 типом); 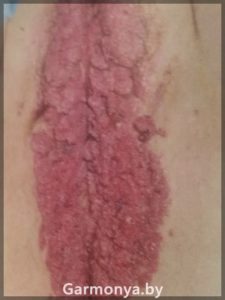
-образование остроконечных кондилом на коже и слизистых половых органов и мочевыводящих путей.
Диагностика
Диагностика заболевания, прежде всего, базируется на жалобах больного и выявленной патологии. При наличие подозрений на патологию шейки матки исключаются половые инфекции, выполняется вульво- и кольпоскопия шейки матки. Выполняется цитологическое исследование слизистой экто- и эндоцервикса шейки матки, бактериоскопическое исследование биологического материала.
При обнаружении дисплазии шейки матки спектр диагностических исследований расширяется. Требуются биопсия шейки матки, кюретаж цервикального канала и ряд дополнительных исследований, регламентирующихся протоколами Министерства здравоохранения.
Нужно обратить внимание на то, что все женщины с подозрением на ПВИ, как и мужчины, обязательно должны пройти обследование на сифилис, СПИД, гепатит В и С. В сомнительных случаях обследование крови на сифилис необходимо повторить.
Современный взгляд на проблему лечения ВПЧ
Папилломавирусная инфекция (ПВИ) так часто встречается и последствия ее настолько значительны, что, принимая во внимание расходы на её диагностику и лечения всех возможных патологий, например, в США ее относят к самой дорогостоящей инфекции после СПИДа. Стоимость капиталовложений на проведение исследований и лечение ВПЧ составляет в районе 1,6-6 млрд. долларов в год.
На сегодняшний день специфических препаратов для лечения папилломавирусной инфеккции не создано. Процессы создания и внедрения вакцин еще не завершились полным успехом. Открытие роли ВПЧ также привело в какой-то мере к всплеску гиперлечения. Однако развитие новых технологий позволяет сегодня подобрать уже более грамотную индивидуальную и щадящую методику лечения для каждой конкретной пациентки.
Вероятность самопроизвольного «очищения» от ВПЧ-носительства и возможность самостоятельного излечения склоняет ряд исследователей к наблюдению, особенно у подростков. Но в каждом конкретном случае патологии своя тактика.
Лечение папилломавирусной инфекции у женщин
Существует мнение, что ВПЧ инфекцию излечить нельзя и, соответственно, нет смысла проводить терапию. Это заблуждение. Полностью устранить из организма вирус мы можем на этапе вирусоносительства (до внедрения ВПЧ в клетки). Но даже если существует интегрированная форма ВПЧ (ВПЧ успел внедриться в клетки) лечение должно проводиться, так как это снизит вирусную нагрузку, уменьшит риск развития дисплазии и онкологических заболеваний шейки матки.
Современные возможности лечения папилломавирусной инфекции у женщин включают:
-деструкцию экзофитных образований (кондилом) и атипически измененного эпителия (эрозия, дисплазия шейки матки);
-цитотоксические препараты ( подофиллотоксин, блеомицин,5-фторурацил);
-иммунокорригирующие средства (интерфероны, синтетические иммуномодуляторы, иммуноглобулины и т.д.);
— фотодинамическую терапию (На поверхность патологических образований вносят фотосенсибилизирующее вещество. Под действием определенного спектра света в пораженной ткани происходит трансформация этого спектра и последующий выброс активных форм кислорода, которые разрушают нездоровые клетки);
— профилактическую вакцинацию до вступления в половую жизнь;
— неспецифические средства (антиоксиданты, индолы).
С помощью деструктивных методов можно избавиться от очага поражения.
Локальное лечение деструктивными методами включает в себя электролечение, криолечение, лазеротерапию, химиокоагуляцию и радиоволновое лечение.
В медицинском центре Гармония врачи гинекологи кроме медикаментозного лечения ВПЧ, используют радиоволновую терапию для лечения патологии шейки матки, в том числе и вирусной этиологии.
В настоящее время данный метод признан наиболее передовым. Выполняется лечение шейки матки безболезненно и бескровно. Радиоволновой метод терапии не оставляет стриктур и ожогов на шейке матки и слизистой половых губ при наличии кондилом. Радиоволновой метод терапии может быть рекомендован, в том числе нерожавшим женщинам, при наличии показаний. РВТ процедуры выполняются с помощью американского аппарата Сургитрон.
В заключение хотелось бы отметить, что чем раньше обнаруживается заболевание, тем более эффективны будут любые лечебные мероприятия.
Дорогие женщины берегите свое здоровье, будьте внимательны к себе!
Папилломавирусная инфекция у мужчин
За последние годы проблема заболевания раком половых органов и анальной области мужчин стала крайне актуальной. Связь с ВПЧ вышеупомянутых недугов научно доказана.
Вирус папилломы человека у мужчин определяется в 40-60% случаев, если их половыми партнерами являются женщины с ВПЧ. При этом выявляются те же штаммы вируса, что и у инфицированных пациенток или половых гомосексуальных партнеров, а в 75% на коже и слизистых проявляются характерные признаки инфекции. Болезнь провоцирует снижение иммунного статуса практически во всех случаях.
Необходимо отметить, что необследованный половой партнер – фактор риска возобновления заболевания или реинфекции.
Контингент мужчин для обследования на ВПЧ
— сексуально активные мужчины с большим количеством (более 5) половых партнерш или половых партнеров у гомосексуальных пар и рано начавшие половую жизнь;
— мужчины с жалобами на выделения из полового органа, анального канала, зуд;
— мужчины с любыми образованиями на половом члене и прямой кишке;
— мужчины с кондиломами и папилломами ;
— мужчины, имеющие факторы риска ПВИ;
— мужчины, имеющие инфицированных половых партнеров или партнерш.
В медицинском центре Гармония обследование на половые инфекции и ВПЧ можно выполнить без направления врача, без предварительной записи в кабинете № 1 в Жодино и кабинете № 4 в Борисове с 8.30-19.00.
Перед исследованием не мочиться 2-3 часа, не использовать антибактериальные средства 1 мес.
Время забора крови 8.30-12.30 в процедурном кабинете № 1 в Жодино и процедурном кабинете № 4 в Борисове.
Дополнительную информацию можно получить по нашим контактным телефонам у администраторов медицинского центра.
Вирус папилломы человека и цервикальная интраэпителиальная неоплазия: лечить или не лечить?
Роговская С.И., Короленкова Л.И. Вирус папилломы человека и цервикальная интраэпителиальная неоплазия: лечить или не лечить? // Женское здоровье и репродукция: сетевое издание. 2019. № 11 (42) — № 12 (43). URL: https://journal.gynecology.school/statyi/virus-papillomy-cheloveka-i-cervikalnaja-intrajepitelialnaja-neoplazija-lechit-ili-ne-lechit/(дата обращения: дд.мм.гггг)
Во всем мире и в частности России отмечается заметный рост частоты инфицирования ВПЧ [1, 2]. ВПЧ способен вызывать пролиферацию и малигнизацию эпителия кожи и слизистых оболочек [3]. ВПЧ разделяется на типы с низкой онкогенностью, вызывающие доброкачественные новообразования (папилломы, кондиломы и аногенитальные бородавки), и высокой онкогенностью, инициирующие рак ряда органов [4, 5]. За открытие роли ВПЧ высокого канцерогенного риска (ВПЧ ВКР) в возникновении некоторых видов рака, в том числе рака шейки матки (РШМ), немецкому ученому Харальду цур Хаузену присуждена Нобелевская премия по физиологии и медицине в 2008 году. В настоящее время роль ВПЧ в возникновении предраковых процессов и РШМ общепризнана [6–8].
К облигатному предраку относятся тяжелые плоскоэпителиальные повреждения (high grade squamous intraepithelial lesions, HSIL) — цервикальные интраэпителиальные неоплазии (CIN), включающие CIN II (умеренную дисплазию) и CIN III (тяжелую дисплазию и преинвазивный рак — carcinoma in situ, CIS).
Онкогенный потенциал ВПЧ детерминирован хорошо изученными механизмами. Белки — продукты ранних генов ВПЧ E6 и E7 — стимулируют пролиферацию клеток, приводят к нарушению процессов апоптоза и нарушению защитных регуляторных механизмов, обеспечивающих репарацию ДНК, что способствует дестабилизации генома и появлению морфологически атипических клеток [8–10]. Изучение типов ВПЧ ВКР у ВИЧ-инфицированных и ВИЧ-негативных женщин показало, что наиболее распространенные типы ВПЧ, в первую очередь 16-й типа, у ВИЧ-негативных женщин могут обладать большей способностью избегать иммунного надзора, чем другие типы [11].
Дополнительные факторы риска развития CIN на фоне ВПЧ не уточнены. Большинство исследователей рассматривают как важную причину неоплазии длительное хроническое воспаление в слизистой оболочке, вызванное различными инфекциями, повторными травмами, химическими и термическими раздражителями. Например, микоплазменная и хламидийная инфекции расцениваются как предрасполагающие факторы канцерогенеза РШМ.
Показано, что наличие внутриклеточных возбудителей способствует ко-инфициированию ВПЧ; отмечается их онкогенный синергизм; острое воспаление нередко не излечивается, переходя в хроническую фазу [12, 13]. При хроническом воспалении, синхронном с ВПЧ-инфицированием, происходят постоянный выброс про- и противовоспалительных цитокинов, накопление липидов в клетках, нарушение внутриклеточного баланса и т. п., что в итоге приводит к нестабильности генома и развитию неоплазии. На фоне хронического воспаления в эпителии накапливаются токсические продукты и появляются клетки с признаками атипии [14, 15].
Поскольку причиной РШМ объективно является длительная персистенция ВПЧ онкогенных типов, естественное течение заболевания до инвазии предусматривает многолетнюю (8–10 лет) стадию в виде интраэпителиального поражения CIN II–III/CIS, а шейка матки легко доступна для профилактических, диагностических и лечебных вмешательств, становится ясно, что специалистам предоставлена возможность не допустить развития инвазивной карциномы и излечить неопластический процесс на стадии предрака — CIN. Однако тактика не всегда понятна практическому врачу, особенно в случаях, когда обнаруживаются признаки CIN I–II, аномальные цервикальные мазки неясной степени или имеется расхождение результатов диагностических тестов.
Российские рекомендации 2017 года «Доброкачественные и предраковые заболевания шейки матки с позиции профилактики рака» (письмо МЗ РФ от 02.11.2017 г.) призваны помочь клиницистам в этом [16]. Документ содержит современные рекомендации по классификации, диагностике и лечению предраковых цервикальных заболеваний, ключевые положения которых обобщены ниже.
В соответствии с обновленными клиническими рекомендациями [16], к предраковым состояниям шейки матки относят CIN, которые имеют вероятность регрессии, стабильного течения и прогрессии до следующей степени и далее до инвазивного рака в течение нескольких лет или десятилетий. При этом вероятность регрессии тем ниже, чем больше степень CIN. Чаще CIN I у молодых женщин может регрессировать вследствие спонтанной элиминации ВПЧ. Эта неоднозначность течения процесса обусловливает трудности в составлении алгоритма врачебной тактики у некоторых групп женщин при скрининге и в клинической практике.
Диагностика вируса папилломы человека и цервикальной интраэпителиальной неоплазии
В раннем выявлении предраковых состояний ключевую роль отводят скринингу. Отмечают, что он должен охватывать минимум 70% целевой популяции, чего можно добиться с помощью рассылки приглашений на обследование посредством электронной почты и мобильной связи, а также благодаря использованию технологии самозабора материала. Порядок скрининга рекомендуют следующий [16].
Целевая аудитория — женщины 21–69 лет (после этого периода жизни регулярное наблюдение прекращают при условии предыдущего адекватного скрининга и при отсутствии в течение 20 лет CIN II и более тяжелых поражений).
В возрастной группе 21–29 лет рекомендуют проводить цитологическое исследование минимум каждые 3 года.
У женщин 30–69 лет цитологическое исследование дополняют ВПЧ-тестом; при этом обследование проводят минимум каждые 5 лет.
Данная стратегия не укладывается в стандарты Приказа № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)» (в практике это основной документ, регламентирующий деятельность акушера-гинеколога), в соответствии с которым «мазок на онкоцитологию» следует брать ежегодно, а ВПЧ-тест и вовсе не предусмотрен в рамках ОМС в качестве скринингового метода. Клиницист может лишь посоветовать пациентке пройти комбинированное обследование за свой счет, объяснив, что это, во-первых, отвечает требованиям современных рекомендаций, во-вторых, экономически выгодно, поскольку в случае отрицательных результатов обоих тестов его достаточно проходить 1 раз в 5 лет.
При патологических мазках или выявлении персистирующей ПВИ рекомендована кольпоскопия. Однако наличие или отсутствие воспалительного процесса может существенно менять картину и делает метод достаточно субъективным. Визуальные картины зависят от этапа воспалительного процесса. Так, острый цервицит сопровождают отечность слизистой оболочки, ее гиперемия, подверженность травмированию при контакте. После обработки раствором уксусной кислоты поверхность слизистой оболочки шейки матки нередко бледнеет. При очаговом цервиците на фоне гиперемии выделяют участки с приподнятыми краями и очаговыми скоплениями мелких красных точек (именно так выглядят при кольпоскопии кольцевые петли расширенных субэпителиальных капилляров).
Хроническое воспаление практически не имеет специфической картины: отмечают локальную атрофию многослойного плоского эпителия, очаги акантоза, появление участков ацетобелого эпителия с нежной мозаикой и пунктуацией. Диффузный хронический цервицит может сопровождать крапчатость при выполнении пробы Шиллера.
Клиницисту чрезвычайно важно помнить о том, что кольпоскопическая картина хронического цервицита может демонстрировать признаки, типичные для CIN. Именно поэтому нельзя ограничиться только лечением цервицита. Оно обязательно, но далее необходимо расширить границы диагностического поиска. Следует добавлять бактериоскопическое исследование мазка с окраской по Грамму, ПЦР с верификацией облигатных патогенов (не только хламидий, гонококков и трихомонад, исследование на ВПЧ ВКР).
Воспалительному процессу под силу замаскировать многие патологические изменения шейки матки. Вследствие воспалительного процесса может отмечаться гиподиагностика по результатам традиционных цитологических мазков, так как воспалительные элементы, элементы крови способны нарушать визуализацию и трактовку препарата.
Регенераторные изменения вследствие репарации участков десквамации эпителия при воспалениях могут способствовать цитологической гипердиагностике. Именно поэтому от эффективности лечения хронического воспаления в большой степени зависят точность диагностики других цервикальных заболеваний и их дальнейшая терапия. Недооценка этого факта сопряжена с высоким риском поздней диагностики рака, а переоценка — с чрезмерной хирургической активностью и с необоснованной травматизацией шейки, порой там, где ее можно и нужно было избежать. Клиницисту приходится балансировать между этими крайностями.
Как и в случае с цитологическим исследованием, диагностическая ценность кольпоскопии зависит от ее адекватности. Последнюю определяет состояние цервикального покрова, оценку которого могут затруднить выраженное воспаление эндо- и экзоцервикса с фибриноидными наложениями, обильные гнойные выделения, резкая гиперемия (иногда с десквамацией эпителия), деформации, аномалии строения шейки матки, кровотечения и смыкание стенок влагалища над шейкой матки (например, в III триместре беременности). На информативность кольпоскопии влияет видимость зоны трансформации: если стык эпителиев не виден, нет уверенности в визуализации всех очагов неоплазии. Именно поэтому в заключении к кольпоскопии клиницисту необходимо отразить информацию об адекватности исследования, типе зоны трансформации, видимости переходной зоны — зоны стыка эпителиев —и обозначить характеристики картин [16, 17].
Особую трудность представляет ведение женщин с плоскоклеточными интраэпителиальными поражениями шейки матки низкой степени (low grade squamous intraepithelial lesions, LSIL), которые включают в себя субклинические формы ПВИ, кондиломы и CIN I. Необходимость их деструктивного лечения дискутируется, так как без полного исследования всего аномального эпителия невозможно исключить поражение более тяжелой степени, не представленное в биоптате, при полиморфности повреждений — сосуществование неоплазий разной степени на одной шейке матки [14, 16, 18, 19]. Тактика в отношении LSIL окончательно не определена ввиду того, что после деструктивного лечения отмечается высокий процент рецидивов вследствие поверхностного воздействия на неоплазии эктоцервикса при неполном уничтожении более глубоких очагов CIN по ходу эндоцервикальных крипт [16, 18, 19].
Одновременно следует отметить, что легкие эпителиальные повреждения имеют высокую вероятность спонтанной элиминации — до 90%, а CIN I регрессирует в 60% случаев. В связи с этим для молодых женщин с LSIL, в том числе с CIN I, принята консервативная тактика введения в течение 18–24 месяцев. Представляется оправданным применение при LSIL средств, способствующих регрессу поражений [9, 10, 20–25]. К сожалению, специфические лекарственные средства, гарантированно и полностью элиминирующие ВПЧ и способствующие регрессии дисплазии, на сегодняшний день не созданы. При изучении состояния иммунной системы у женщин, страдающих ПВИ, многими авторами выявлены нарушения различных ее звеньев, а также высокая вероятность сопутствующего хронического воспалительного процесса. Это свидетельствует о целесообразности поиска противовирусных, иммуномодулирующих и противовоспалительных средств, способствующих коррекции иммунной системы и регрессу ПВИ.
Так, в литературе широко представлен опыт применения при ПВИ цидофовира, имиквимода, индол-3-карбинола, а также иммуномодуляторов для местного и системного применения [9, 15, 24, 26]. Среди них интерес представляют недавно созданные средства: гель вагинальный ДефлаГин, дииндолилметан, топические иммуномодуляторы типа Суперлимф и иммуномодуляторы системного действия. Следует отметить, что, несмотря на патогенетическую оправданность и продемонстрированную в исследованиях типа «случай — контроль» эффективность использования некоторых противовирусных и иммуномодулирующих препаратов, данные с высоким уровнем доказательности пока не представлены.
Важно следовать стандартной тактике и понимать, что при HSIL — CIN II–III/CIS применение противовирусных и иммуномодулирующих средств возможно лишь в дополнение к эксцизионному вмешательству (петлевой эксцизии зоны трансформации или конизации) в комбинированном лечении, но не в качестве монотерапии.
Комбинацию с хирургическим методом лечения следует применить также у больных с CIN I по истечении 18–24 месяцев неэффективного консервативного ведения и у пациенток старше 35 лет.
В качестве дополнения к хирургическому лечению у женщин с CIN можно использовать препарат с наибольшей доказательной базой инозин пранобекс, обладающий противовирусным и иммуномодулирующим свойствами [22]. На территории РФ зарегистрированы два бренда. Гроприносин под торговым наименованием является из двух дженериков эталонным референтным препаратом, согласно Реестру лекарственных средств. Референтный препарат — термин, введенный в 2015 году в качестве замены «оригинальному лекарственному препарату» или «препарату сравнения».
Иммуномодулирующее действие инозина пранобекса обусловлено увеличением продукции интерлейкинов, усилением пролиферации Тхелперов, стимуляцией хемотаксической и фагоцитарной активности моноцитов, макрофагов и полиморфноядерных клеток, а также подавлением репликации ДНК- и РНК-вирусов посредством связывания с рибосомами клетки и изменения их стереохимического строения. В исследовании Y. You и соавт. продемонстрировано, что инозин пранобекс позволяет уменьшить/прекратить вирусовыделение в очаге инфекции, улучшить заживление и увеличить безрецидивный промежуток [22].
Одна из таких работ проведена на базе Национального медицинского исследовательского центра акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова (Москва) [18]. Гроприносин был испытан в комплексной терапии 72 женщин, инфицированных ВПЧ ВКП, с гистологически подтвержденным поражением типа LSIL. Пациенток распределили на две равные группы: представительницам первой проводили хирургическое лечение и назначали указанный препарат, во второй ограничивались только оперативным вмешательством.
В качестве хирургического метода применена лазерная деструкция (выполняли на 5–9й день менструального цикла при условии полной кольпоскопической визуализации зоны трансформации). Инозин пранобекс назначали за 10–14 дней до деструкции в дозе 1000 мг 2 раза в сутки на протяжении 10 дней. Курс повторяли еще в течение 10–14 дней после операции.
Согласно результатам исследования, у получавших комбинированное лечение эпителизация шейки матки протекала быстрее, через 6 месяцев зарегистрировано отсутствие ВПЧ в очаге поражения (по данным ПЦРконтроля). Клиническое излечение (по результатам цитологического и кольпоскопического исследований) отметили у 92% пациенток после комбинированного и у 78% после хирургического лечения.
Еще в одном российском наблюдении 2016 года (n = 62) оценили эффективность комплексного подхода с использованием деструктивных методов лечения и инозина пранобекса у больных CIN I, что любопытно, с учетом соблюдения или несоблюдения врачебных рекомендаций относительно приема иммуномодулятора [21]. Всем участницам выполнили аргоноплазменную коагуляцию шейки матки, а также назначили 10дневные курсы инозина пранобекса за 2 недели до абляции и через 2 недели после нее.
«Норма» по результатам цитологического и кольпоскопического исследований через 3 и 6 месяцев выявлена у 97,5% и 86,4% принимавших инозин пранобекс согласно предписанным рекомендациям и отступивших от них. Выделение вируса из очага поражения в первые 2 месяца после лечения прекратилось у 92,5% и 63,6% пролеченных. Частота рецидивов атипических изменений за исследуемый период (6 месяцев) — 2,5% и 13,6%.
Таким образом, инозин пранобекс можно применять в составе комбинированного лечения (как дополнение к хирургическому вмешательству) для улучшения его результатов, уменьшения вероятности неизлеченности и рецидивов. Российские клинические рекомендации 2017 года такое назначение считают допустимым.
Инозин пранобекс при герпес-вирусной инфекции, согласно недавнему крупному исследованию в Китае, был так же эффективен, как и ацикловир, но более значительно снижал частоту рецидивов генитального герпеса [22].
Опубликованы еще несколько исследований опыта применения инозина пранобекса. Метаанализ результатов клинических исследований, посвященных лечению ВПЧ, позволяет констатировать целесообразность применения инозина пранобекса в данной группе пациенток, хотя многие из анализируемых клинических испытаний не отвечают требованиям доказательной медицины, так как не являются двойными слепыми плацебо-контролируемыми.
Лечить или выжидать?
В упоминаемом выше российском документе 2017 года [16] также нашла отражение лечебная тактика при доброкачественных и предраковых состояниях шейки матки. При истинной эрозии необходима патогенетическая терапия, то есть устранение причины, вызвавшей десквамацию эпителия (воспаления, травмы, возрастных атрофических процессов слизистой оболочки). Неосложненный эктропион шейки матки, эктопия цилиндрического эпителия лечения не требуют. Необоснованная деструкция, которой «грешат» российские клиницисты, в случае неоплазии не предупредит развитие неопластического процесса в скрытой части канала и может затруднить диагностику [16]. При лейкоплакии шейки матки вначале необходимо устранить сопутствующий воспалительный процесс, после чего исключить CIN.
В документе подчеркивают, что лейкоплакию отличает упорное, рефрактерное к терапии течение, в связи с чем при этом типе поражения оптимально избрать наблюдательную тактику, но предварительно провести гистологическое исследование для исключения CIN.
У молодых женщин с LSIL (с признаками ВПЧ-инфекции, койлоцитозом, CIN I), а также с CIN II при условии негативного результата теста на онкобелок р16 и удовлетворительного результата кольпоскопии с визуализацией всей зоны трансформации возможна наблюдательная тактика с повторением цитологического исследования через 6, 12, 24 месяца.
При сохранении CIN I более 2 лет от выжидательной тактики переходят к хирургическому лечению, в основном посредством эксцизии; деструкция возможна, только если видна вся зона трансформации с переходной зоной, возраст женщины менее 35 лет, аномалии в мазках из эндоцервикса отсутствуют и риск поражения эндоцервикальных крипт минимален.
При персистенции CIN II предпочтительна эксцизия, даже если пациентка очень молода. При HSIL (CIN II и положительном тесте на онкобелок р16, а также при CIN III) независимо от возраста пациентки лечение начинают без промедлений: методом выбора служит петлевая эксцизия.
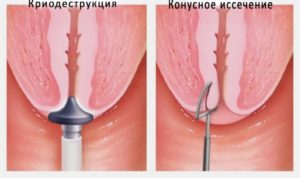
В целом, к хирургическим методам лечения предрака относят:
– абляцию — разрушение пораженного участка эпителия шейки матки путем электро-, радио-, лазерной и криодеструкции;
– эксцизию — иссечение аномальной ткани тонкими проволочными петлями различных размеров и форм с захватом части цервикального канала разной глубины.
К абляции прибегают строго при соблюдении следующих условий:
– отсутствуют подозрения на CIN II, CIN III, CIS, инвазивный рак;
– зона трансформации видна полностью;
– нет признаков поражения эктоцервикальных желез;
– отсутствуют данные о вовлеченности эндоцервикса в патологический процесс;
-ранее не проводили хирургическое лечение шейки матки;
-нет расхождений между результатами цитологического, гистологического и кольпоскопического исследований.
Заключение
Предраковые цервикальные интраэпителиальные поражения шейки матки инициированы и ассоциированы с персистенцией ВПЧ высокого канцерогенного риска, и ВПЧ-тест является важным инструментом скрининга и ранней диагностики неопластического процесса. Сопутствующее хроническое и острое воспаление становится ко-фактором персистенции ВПЧ и затрудняет цитологическую и кольпоскопическую диагностику CIN. Информативность кольпоскопии зависит от видимости переходной зоны: отсутствие видимости зоны стыка эпителиев уменьшает точность диагностики степени CIN в биоптатах эктоцервикса.
В связи с высокой вероятностью регрессии LSIL у молодых женщин с первым типом зоны трансформации возможно наблюдение в течение 18–24 месяцев. При консервативном введении пациенток с LSIL и при комбинированном лечении женщин с CIN в дополнение к хирургическим методам возможно использование противовирусных и иммуномодулирующих средств для уменьшения рисков сохранения вирусной нагрузки, неизлеченности и рецидивов