что такое пхт в медицине
Химиотерапия: что это и как ее делают при онкологии
Лекарственная противоопухолевая терапия, в том числе и химиотерапия, – один из основных методов лечения рака. При химиотерапии в человеческий организм вводятся различные токсические вещества, которые губительно воздействуют на клетки злокачественных опухолей. Важно при этом, чтобы яды и токсины оказывали наименьшее отрицательное воздействие на весь организм больного.
Схемы химиотерапевтического лечения регламентируются международными методиками и правилами, и рассчитываются индивидуально. Врач-химиотерапевт подбирает пациенту лечение, руководствуясь различными критериями, среди которых:
Виды химиотерапии
Сложные комбинации из нескольких химиопрепаратов на сегодняшний день используются чаще, так как они более эффективные.
Химиотерапия нередко применяется как часть комбинированного лечения рака:
Дозы и режимы применения противоопухолевых препаратов
Противоопухолевые лекарственные препараты и их дозировка подбираются строго индивидуально.
У каждого препарата имеются свои характеристики и особенности. При проведении химиотерапии важными являются следующие параметры:
Дозу препарата рассчитывают исходя из схемы химиотерапии, роста, веса, возраста, состояния больного, а в некоторых случаях, на основании лабораторных показателей пациента.
Режимы
Если необходимо повысить интенсивность химиотерапии, то увеличивают дозу препарата, это так называемая высокодозная терапия, либо сокращают интервал между курсами ХТ, то есть вводят уплотненные режимы.
Также существуют метрономные режимы применения цитостатических препаратов, когда вводятся малые дозы препаратов, но постоянно в течение длительного времени.
После каждого курса химитерапевтического лечения обязательно делается определенный перерыв для восстановления организма. Как правило, повторные курсы ХТ проводят через каждые три-четыре недели, это период, в течение которого восстанавливаются показатели лейкоцитов, тромбоцитов и пр.
При использовании некоторых химиопрепаратов, к примеру, нитрозопроизводных, этот интервал увеличивается до 6 недель.
Продолжительность лечения и количество курсов химиотерапии зависит от вида опухоли, от особенностей течения болезни от того, как организм реагирует на лечение. Иногда возникает необходимость прекратить или изменить лечение, и это решение принимает лечащий врач.
Способы применения химиопрепаратов
Правила введения противоопухолевых препаратов
Наиболее широко используется внутривенное введение противоопухолевых средств. При этом врач обязательно учитывает индивидуальные особенности вен пациентов.
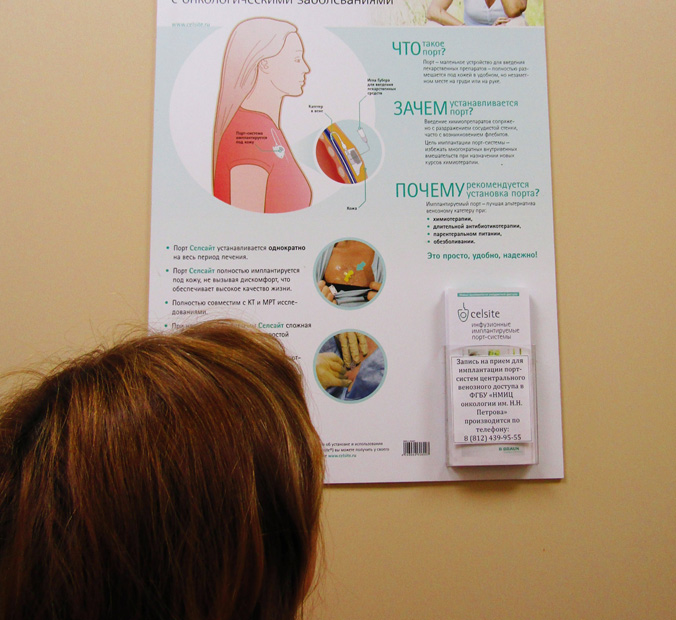
Имплантируемые порт-системы
Имплантируемая порт-система — это катетер, установленный в сосуд или полость и соединенный с ним резервуар-камера. Система «порт — катетер» широко используется в медицине уже более чем 30 лет.
Порт-системы помогают проходить лечение более эффективно, безопасно и качественно. Особенно актуальна их установка в качестве устройства сосудистого доступа пациентам, которым назначено длительное лечение, при осложнениях на фоне химиотерапии, которые привели к затруднению венозного доступа.
При этом терапию пациент может получать как в условиях стационара, так и амбулаторно.
Инфузия лекарственных препаратов производится с помощью специальных игл типа Губера, которые, пунктируя силиконовую мембрану порта, позволяют вводить инфузионный раствор в резервуар, не повреждая силиконовую мембрану. Далее препарат попадает через катетер в кровоток или полость, в зависимости от вида порт-системы и места расположения катетера.
Порт- система полностью скрыта под кожей. Поэтому она подходит для длительного использования, не обременяет пациента и не мешает проведению гигиенических процедур. Необходимо помнить, что при отсутствии использования порт-систему необходимо промывать как минимум 1 раз в 2 месяца.
Подготовка к химиотерапии
Чтобы не было проблем с поиском вен и установкой катетера за день до химиотерапии желательно выпить 1,5-2 литра жидкости.
Для тренировки вен рекомендуется периодически сжимать кистевой эспандер по 10 мин 3 раза в день или до усталости. При этом рука должна быть свешена ниже уровня сердца.
В день проведения ХТ нужно держать руки в тепле, возможно применение теплых обертываний на места инъекций. Можно периодически обрабатывать руки теплыми полотенцами.
Во время прохождения химиотерапии
В день химиотерапии, с утра необходимо позавтракать.
Далее необходимо соблюдать несколько несложных правил:
Об осложнениях после химиотерапии читайте здесь.
Возможно ли повысить эффективность химиотерапии?
Поиск основных направлений повышения эффективности терапии опухолей осуществляется в разных направлениях:
Паллиативная химиотерапия
Паллиативная химиотерапия проводится онкологическим пациентам в том случае, когда радикальное излечение невозможно, но реально достичь временной ремиссии, стабилизации или приостановить дальнейшее прогрессирование заболевания. Как правило, это поздние стадии рака с наличием отдаленных метастазов.
Цель паллиативной химиотерапии не только улучшение качества жизни пациента с онкологическим диагнозом, но и ее продление. Она позволяет контролировать симптомы, предотвращать осложнения и увеличивает выживаемость пациентов с диссеминированными опухолями на месяцы и годы. Благодаря уменьшению размеров или приостановления роста опухоли уменьшаются клинические проявления онкологического заболевания.
Задачи паллиативной химиотерапии:
Круглова Марина Сергеевна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
При каких видах рака проводится паллиативная химиотерапия?
Паллиативная химиотерапия проводится при многочисленных нозологиях, в том числе при метастатическом раке молочной железы, раке яичников, раке легкого, раке желудка, колоректальном раке. Эффективность паллиативной химиотерапии подтверждена многочисленными клиническими испытаниями, включая рандомизированные исследования.
Выбор режима паллиативной химиотерапии рака желудка будет зависеть от предыдущего лечения от общего состояния пациента. Как правило, это полихимиотерапия, включающая 2-3-4 цитостатика. Также при метастатическом раке желудка можно провести генетическое тестирование для выявления маркеров опухоли (HER2neu, PD-L1, MSI), чтобы назначить иммунотерапию или присоединить таргетную терапию.
Паллиативная химиотерапия является главным методом лечения пациентов с метастатическим раком толстой кишки. Существует много активных химиопрепаратов, которые можно использовать в различных комбинациях. Паллиативная химиотерапия проводится непрерывно. Первая линия назначается до прогрессирования заболевания, то есть до тех пор, пока опухоль кишечника реагирует на лечение, дальше подбирается следующая линия терапии.
При метастатическом раке толстой кишки так же можно провести молекулярно-генетическое тестирование, по результатам которого возможно присоединить таргетные или иммунопрепараты.
В арсенале паллиативного лечения метастатического рака молочной железы сегодня есть и паллиативная химиотерапия, и таргетные препараты, и бисфосфонаты.
Метастатический рак молочной железы хорошо поддается лечению, и во многих случаях паллиативная химиотерапия позволяет достичь длительной ремиссии.
Совсем недавно появился новый таргетный препарат Пертузумаб, который показывает высокую эффективность при метастатическом поражении головного мозга при раке молочной железы с гиперэкспрессией HER2neu. Пертузумаб в комбинации с трастузумабом и доцетакселом позволяет достичь медианы общей выживаемости в 34,4 месяца, что является беспрецедентным результатом.
Результаты клинических исследований различных режимов паллиативной химиотерапии также свидетельствуют о значительном увеличении общей продолжительности жизни, которая в среднем составляет около 4-4,5 лет. В то время как применение только симптоматической терапии у данной категории больных увеличивает продолжительность жизни лишь на 3-5 месяцев.
При раке яичников прогрессирование происходит преимущественно за счет распространения метастазов по брюшине и отличается малосимптомным течением на ранних стадиях. В связи с этим около 70% больных на момент постановки диагноза имеют III или IV стадию, требующую выполнения циторедуктивной операции и проведения паллиативной химиотерапии.
Более 50% больных с распространенным раком яичников достигают полной клинической ремиссии после современного комбинированного лечения. Однако у большинства из них в течение первых трех лет развивается рецидив. Пятилетняя выживаемость больных с распространенным раком яичников, получающих комбинированное лечение, составляет 10%.
Паллиативная химиотерапия при раке предстательной железы
При прогрессировании заболевания на данных режимах появилась возможность выбора последующих линий паллиативной химиотерапии – Кабазитаксел, Митоксантрон, Энзалутамид или радионуклидная терапия препаратом радий-223 (Ксофиго).
Развивается персонализированная терапия, и, если у пациента обнаружены мутации BRCA-1,2, возможно назначение PARP-ингибиторов – например, препарата Олапариб.
Непрерывное проведение адекватного противоопухолевого лечения позволяет продлить жизнь пациентам с распространенным раком предстательной железы на 3-5 и более лет.
В нашу онкологическую клинику обращаются пациенты на всех стадиях заболевания, в том числе и поздних. Мы убеждены, что паллиативное лечение не ограничивается только назначением схемы химиотерапии, оно гораздо шире и сочетает в себе общение с пациентом и его родственниками, уход, сочетание профессиональных и таких личных качеств, как забота и неравнодушие.
Для прохождения паллиативной химиотерапии позвоните по телефонам клиники: +7 (812) 952-83-73, +7 (812) 318-59-90.
Что такое пхт в медицине
Последние научные исследования документируют роль химиотерапии в обеспечении контроля за симптомами, предотвращении осложнений, продлении жизни и улучшении качества жизни у пациентов с неизлечимыми раковыми образованиями [36,38,49,68,70]. Лекарственная терапия способна увеличить выживаемость диссеминированных больных на месяцы и годы [3,12,22,26,40,43,45].
Итак, химиотерапия солидных опухолей разделяется на следующие категории:
Неоадъювантная химиотерапия назначается до операции или облучения [11,17,35,46,69]. При этом преследуются цели: уменьшить массу и биологическую активность опухоли, увеличить резектабельность опухоли и абластичность предстоящей операции, определить лекарственный патоморфоз (чувствительность опухоли к химиотерапии) [18].
Адъювантная терапия – вспомогательное, дополняющее хирургические и лучевые методы лекарственное лечение [7,10,11,46,78]. Иногда такую терапию называют профилактической. Целью адъювантной терапии является эрадикация или длительное подавление микрометастазов рака после удаления или лучевого излечения первичной опухоли [17,21,26,55].
Паллиативная химиотерапия проводится при местно- или отдаленно распространенных неоперабельных опухолевых процессах заведомо инкурабельному пациенту, с заведомо нерадикальной целью.
Нередко как отечественные, так и зарубежные онкологи обобщают или не совсем верно интерпретируют термины “паллиативная помощь (palliative care)”, “паллиативная терапия (palliative therapy)”, “поддерживающая (или сопроводительная) терапия (supportive care)”, “терминальная помощь (terminal or end of life care)”. Чтобы внести ясность в довольно запутанную и спорную терминологию, специальная группа экспертов ESMO официально дала свои определения для некоторых из указанных терминов [42]:
“Supportive care” поддерживающая терапия (дословно с английского: поддерживающий уход за больным) определяется как уход/помощь с целью оптимизировать комфорт, функцию и социальную поддержку пациентов и их семей, при всех стадиях заболевания.
“Palliative care” паллиативная помощь (дословно с английского: паллиативный уход за больным) – определяется, как уход/помощь с целью оптимизировать комфорт, функцию и социальную поддержку пациентов и их семей, когда излечение невозможно.
Паллиативная помощь.
В связи с быстрым ростом заболеваемости злокачественными новообразованиями во всем мире, в 1982 году ВОЗ объявила о необходимости создания нового направления здравоохранения и предлагает определение паллиативной помощи. Изначально паллиативной помощью считалось симптоматическое лечение больных злокачественными новообразованиями, сейчас это понятие распространяется на пациентов с любыми инкурабель-ными хроническими заболеваниями в терминальной стадии развития, среди которых, конечно, основную массу составляют онкологические больные [2].
Критериями отбора для оказания паллиативной помощи являются: ожидаемая продолжительность жизни не более 3-6 мес.; очевидность того факта, что последующие попытки лечения нецелесообразны; наличие у больного жалоб и симптомов, которые требуют специальных знаний и уме-ний для проведения симптоматической терапии и ухода [2].
Паллиативная терапия.
В потоке стремительного развития паллиативного направления в мировом здравоохранении постепенно развилось понятие паллиативной терапии в онкологии [34]. В отличие от таковой помощи, паллиативная терапия преследует цель не только улучшения качества, но и что еще важнее – продления жизни больного [64,81].
К сожалению в общепризнанных международных медицинских терминологический базах (NCI, MeSH, SNOMED CT) на настоящий день отсутствует определение термина “паллиативная терапия”, но это лишь вопрос времени, поскольку с каждым днем указанный термин приобретает все большую актуальность, на что указывают многочисленные научные публикации цитируемые в данной работе, и не только.
Все основные методы лечения в онкологии – хирургический, химиотерапия, гормонотерапия, иммунотерапия, радиотерапия могут быть применены в качестве паллиативного [13,32,57,81]. Хирургический и радиологический методы лечения ограниченно применяются при распространенных злокачественных процессах, и в основном имеют узко симптоматический характер при ряде неотложных состояний [6].
Паллиативные операции по своим целям можно условно разделить на две группы:
Подобное деление достаточно условно. Как правило, паллиативная операция несет задачи как циторедуктивного, так и симптоматического вмешательства [18].
Паллиативная лучевая терапия в основном применяется для максимального торможения и снижения темпа роста опухоли при ряде кли-нических симптомов – явлений компрессии жизненно важных органов, деструктивном поражений костной системы, а также для достижения длительного локорегионального контроля при некоторых видах местнораспространенных опухолей или метастазов [7]. Около 34–50% всех случаев радиотерапии проводятся именно с паллиативной целью [81].
Паллиативная химиотерапия (ПХТ).
Основная роль в паллиативном лечении онкологических больных принадлежит лекарственному лечению, характер которого в большей мере лечебный, чем симптоматический, и позволяет продлить жизнь больных на месяцы или даже годы [37,39,56,75].
Клинические испытания, включая рандомизированные исследования, демонстрируют определенное улучшение качества жизни и выживания с помощью паллиативной химиотерапии при метастатическом раке молочной железы, яичников, легкого, метастатическом колоректальном раке [6,36,47, 66,71,74].
Ниже приводится краткий обзор наиболее распространенных локализаций рака, при которых широко используется данный метод лечения.
Рак легкого (РЛ).
РЛ – главный онкологический киллер по всему миру. В мире ежегодно заболевают более 1.6 млн. человек, умирают – 1.3 млн. Средняя выживае-мость в Европе составляет 10% [3].
Рак легкого I–II клинических стадий выявляется всего у 20–22% больных, у остальных на момент установления диагноза определяют III–IV стадии, хирургическое лечение этой группе больных не показано, так как не обеспечивает адекватного лечебного эффекта [3].
Лечение больных IV стадией РЛ следует расценивать только как паллиативное или симптоматическое. Это может быть полихимиотерапия, химиолучевая или лучевая терапия. Выбор варианта лечения зависит от общего состояния больного, количества и локализации метастазов. Больные в удовлетворительном общем состоянии с небольшим числом метастазов имеют, как правило, лучший лечебный эффект [19].
Доказано, что использование системной паллиативной химиотерапии у больных с неоперабельной IIIB и IV стадиями рака легкого даёт улучшение выживаемости по сравнению с оптимальной симптоматической терапией или плацебо [9,28,46]. При IIIB и IV стадиях больные с поддерживающей терапией живут 4 мес.; 1 год выживают 10%. При использовании стандартной химиотерапии однолетняя выживаемость доходит до 30% [3].
Рак молочной железы (РМЖ).
Рак яичников (РЯ).
РЯ, занимая 3-е место по заболеваемости среди онкогинекологической патологии, является второй ведущей причиной смерти у этой категории больных, ежегодно унося жизни около 140 000 женщин во всем мире [18,29, 53].
При раке яичника прогрессирование происходит преимущественно за счет диссеминации по брюшине и отличается малосимптоматическим течением при ранних стадиях. Благодаря этому около 70% больных в момент постановки диагноза имеют распространенный процесс III или IV стадии [18], требующий выполнения циторедуктивной операции и проведения химиотерапии [29,41]. Более 50% больных с распространенным раком яичника достигают полной клинической ремиссии после современного комбинированного лечения, хотя у большинства из них в течение первых трех лет развивается рецидив [31]. Пятилетняя выживаемость больных с распространенным раком яичников составляет лишь 5% [18].
Колоректальный рак (КРР).
Вышеуказанные данные свидетельствуют о большой и незаменимой роли паллиативной химиотерапии в лечении наиболее распространенных метастатических форм рака. Нельзя переоценить роль лекарственного лечения при распространенных раковых процессах – множество больших научных исследований показывают преимущество химиотерапии перед симптоматическим лечением в тех случаях, когда нет шанса на полное выздоровление больного. ПХТ однозначно повышает выживаемость боль-ных, при этом, практически не ухудшая качества их жизни [37,50,75]. Более того, доказана целесообразность назначения ПХТ вне зависимости от нали-чия симптомов заболевания [37,48,67].
Особенности и вопросы ПХТ.
Более детальное ознакомление с нюансами назначения и проведения ПХТ выявляет ряд задач, с которыми часто сталкивается химиотерапевт в практической деятельности.
Показания к лечению.
В дополнение к вышесказанному добавим, что некоторые специалисты относят к паллиативной химиотерапии так называемую “химиотерапию спасения” (salvage chemotherapy) [63], что, на наш взгляд, неверно, поскольку данный вид лечения представляет собой интенсивную химиотерапию при резистентных, но не запущенных формах злокачественных процессах [45] и преследует цель полного излечения (спасения). Само понятие интенсивной, ударной химиотерапии противоречит принципу паллиативной химиотерапии – поддержание качества жизни больного.
Цели и критерии эффективности ПХТ.
Исходя из преследуемых целей, соответственно различны также и критерии эффективности лечения.
Основными критериями эффективности куративного лечения являются отдаленные результаты лечения – общая и безрецидивная выживаемость [17,18]. При паллиативном лечении, именно непосредственные объективные и субъективные эффекты лечения имеют первостепенное значение. Отдален-ными критериями эффективности паллиативной химиотерапии служат как общая, так и безсобытийная выживаемость, где под событием могут подразумеваться как рецидив, так и прогрессия заболевания, в зависимости от требований исследования [4]. ПХТ может продолжаться неопределенно долго, пока этого позволяет общее состояние больного и опухоль остается чувствительной к лечению.
Показатели эффективности лекарственного лечения в онкологии:
Традиционно в течение долгого времени для оценки объективного эффекта использовались критерии комитета экспертов ВОЗ. С 2000г в международных клинических исследованиях стала использоваться новая методика оценки эффективности терапии солидных опухолей по шкале RECIST (Responsible Evaluation Criteria In Solid Tumors). [17]
Критерии объективного эффекта лечения по шкале RECIST:
При оценке объективного эффекта учитывается также динамика биохимических и других лабораторных показателей. В частности особенная роль в оценке течения лечения при некоторых формах рака принадлежит онкомаркерам – специфичным субстанциям, определяемым в крови боль-ных при активности заболевания [8,24,30,54,59].
Субъективный эффект оценивают по изменению статуса, умень-шению или исчезновению симптомов заболевания и изменению массы тела. Статус больного (Perfomance status) оценивают до начала лечения, в процессе и после его окончания по 5-степенной системе ВОЗ (ECOG-WHO), представляющую собой модификацию шкалы Карновского [17].
Для оценки субъективного эффекта лечения особое значение придается качеству жизни больных (Quality of Life – QОL) [51,61,73,77]. Для оценки качества жизни пользуются специальными анкетами, которые заполняются больными в процессе лечения. Чаще всего используется анкета EORTC QLQ-30, содержащая 30 основных вопросов, характеризирующих качество жизни [17].
Сбалансированность лечения.
Еще одним важным вопросом ПХТ является выбор средств лечения. В “паллиативном режиме” лечения не все средства оправдывают цели, то есть стандартная химиотерапия, применяемая в куративном лечении, не всегда подходит к ПХТ. В частности, речь идет о выборе режимов проведения лечения.
Различия куративной и паллиативной терапий касаются требований к ожидаемой токсичности химиотерапии и к удобству ее проведения [60]. Высокая токсичность терапии, по принципу максимально переносимой дозы в минимальный промежуток времени (maximum tollerated dose), допустима при курабельных опухолях и не может быть оправдана при лечении распрос-траненных процессов [7].
Трудность состоит в обеспечении баланса между качеством и длитель-ностью жизни. Задача в том, что одна цель частично противоречит другой: для продления жизни больного необходима эффективная химиотерапия, которая, в свою очередь, обладая ощутимыми побочными действиями, отри-цательно сказывается на качестве жизни больного в течение лечения. Факти-чески, больной избавляется от симптомов заболевания ценой побочных эффектов химиотерапии. В тоже время, продолжительность жизни находится в прямой зависимости от длительности лечения.
Следовательно, ключевыми вопросами при выборе лечебной тактики являются следующие: [1]
Удобство проведения лечения не имеет большого значения при опера-бельных формах рака и выступает важным фактом при распространенных поражениях, требующих длительного применения противоопухолевых препаратов.
В настоящее время при большинстве опухолей обсуждается не целесообразность и эффективность химиотерапии, а детали ее использования (показания к назначению конкретного противоопухолевого агента или их комбинаций, методика введения, дозы). Именно в деталях, методике использования химиопрепаратов заключается главная практическая проблема химиотерапии [19].
К основным принципам проведения химиотерапии, имеющим практическое значение, относятся: [17]
Перечисленные принципы ведут к соответствующему ряду клиничес-ких вопросов, которые постоянно сопровождают работу химиотерапевта: какому препарату, дозировке, схеме, режиму отдать предпочтение при их одинаковой эффективности? На основе каких критериев осуществлять коррекции режимов ХТ?
К сожалению, практические онкологические руководства не в полной мере дают ответы на данные вопросы, более того, предлагая целые ряды идентичных по эффективности схем химиотерапии, затрудняют выбор лечения для клинициста [18,17,33]. Приблизительные дозы и рекомендуемая методика введения препарата, конечно же, определяются характером используемого противоопухолевого средства и отрабатываются в процессе клинических испытаний. Но с практической точки зрения очень важно определить конкретную дозу химиопрепарата при конкретном клиническом случае.
Одной из известных “особенностей” химиотерапии является отсутствие единых общепринятых протоколов лечения для всех видов опухолей [6,41]. Так называемые “золотые стандарты” химиотерапии относятся лишь к некоторым стадиям ряда опухолей.
Слишком часто крупнейшие онкологические центры мира не сходятся во взглядах в использовании схем химиотерапий при многих видах опухолей. Клинические испытания по выявлению оптимальных схем лечения при разных формах рака беспрерывно проводятся во всех крупнейших исследовательских центрах мира, но редко какая схема лечения претендует на однозначное первенство [15].
Более неопределенна ситуация в паллиативном лечении рака, где, как уже говорилось, совершенно иные цели лечения. Если при стандартной химиотерапии существуют более или менее утвержденные схемы и методики проведения химиотерапии, то с уверенностью можно сказать, что они не совсем приемлемы для ПХТ.
Несмотря на большое количество клинических исследований в области онкологии, до сих пор не показано однозначного преимущества каких-либо схем ХТ при распространенных формах рака [12]. Именно по этой причине разные онкологические центры, даже в пределах одной страны, часто не сходятся в выборах дозировок, схем и режимов ПХТ. Немаловажна также финансовая сторона вопроса – новейшие высокоэффективные химиопрепараты стоят слишком дорого и доступны для бюджета немногих стран.
Данный вопрос останется дискутабельным, пока ведутся исследования с целью выявления более эффективных препаратов и схем лекарственного лечения рака.
Коррекция режимов химиотерапии.
Итак, становится ясно, что при проведении паллиативной химиотерапии в большинстве случаев необходимо корректировать стандартные режимы химиотерапии, подстраивая их к функциональному состоянию орган-систем и возрасту пациента, а также к переносимости лечения [1,60,81].
Учитывая, что одной из основных задач, стоящих перед врачом при терапии метастатического рака, является сохранение качества жизни, предпочтение отдается препаратам и режимам с наименьшей токсичностью. Снижение токсичности — одна из приоритетных задач, так как при лечении хронических заболеваний проводимая терапия не должна сама по себе значительно ухудшать качество жизни пациента [9].
Средством защиты организма от побочных явлений служит сопроводительная терапия, которая в обязательном порядке проводится параллельно с химиотерапией, и позволяет контролировать основные токсические проявления лечения [20,23,]. Но даже самая качественная сопроводительная терапия не в силах полностью предотвратить весь спектр побочных эффектов цитостатиков. Необходимы дополнительные меры для обеспечения приемлемого качества жизни больного. Именно по этой причине в практической онкологии возникает необходимость корректировки режимов ХТ [82].
Коррекция режимов ХТ возможна некоторыми способами:
Основным и более употребляемым методом коррекции является редукция доз химиопрепаратов. Но часто используются комбинации двух или более методов.
При стандартной химиотерапии, редукция доз химиопрепаратов производится только по строгим показаниям, во избежание серьезных осложнений [17]. При паллиативной химиотерапии, по нашему мнению, редукция доз должна применяться более широко, и ее целью должно являться предотвращение не только функциональных осложнений, но также ухудшения самочувствия больного. В тоже время недопустимо применение излишней редукции доз химиопрепаратов, поскольку это резко снизит эффективность лечения, делая его нецелесообразным [51,76].
Неудовлетворительное общее состояние больных с неоперабельным и распространенным раком ограничивает возможности проведения лекарственного лечения, а нередко является основанием для отказа от проведения такового [6,25]. Возраст больного также играет важную роль [6], поскольку распространенный раковый процесс в большей мере встречается в контингенте пожилых пациентов [37]. Проведение химиотерапии больным данной возрастной группы сопряжено с повышенным риском развития осложнений, что является следствием физиологических изменений в организме, присущих пожилому возрасту [20]. Именно поэтому необходим специфический подход в паллиативной химиотерапии, в особенности у пожилых больных [58,79].
Все вышесказанное указывает на необходимость проведения исследований, посвященных разностороннему изучению и совершенствованию методик паллиативной химиотерапии.
Литература