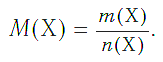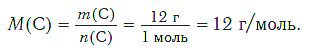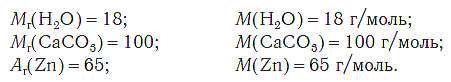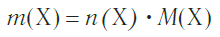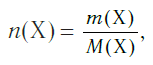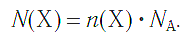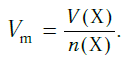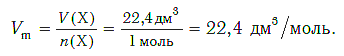что такое постоянный вес в химии
Что такое постоянный вес в химии
Закон сохранения массы теоретически был описан в 1748 г, а экспериментально подтверждён в 1756 г. русским учёным М.В. Ломоносовым. М.В. Ломоносов определил, что если сосуд с металлом взвесить до и после нагревания, не вскрывая его, то масса останется неизменной. В 1789 г. французский учёный Антуан Лавуазье подтвердил выводы М.В. Ломоносова.
Формулировка закона сохранения массы:
масса веществ, вступивших в реакцию, равна массе продуктов реакции.
Атомно-молекулярное учение объясняет этот закон так: при химической реакции общее количество участвующих атомов не изменяется, а происходит лишь их перегруппировка. Так как число атомов до и после реакции не изменяется, то их общая масса тоже не изменяется.
С точки зрения атомно-молекулярного учения при химических реакциях атомы не образуются из ничего и не исчезают, поэтому число атомов всех видов в ходе химической реакции остается неизменным. А так как масса данного атома постоянна, то и общая масса исходных веществ, состоящих из этих атомов, равна массе продуктов реакции, которые состоят из того же набора атомов.
Например, для реакции
в соответствии с законом сохранения массы должно выполняться соотношение
называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов.
Уравнение химической реакции даёт качественную и количественную информацию о химической реакции, реагентах и продуктах реакции; его составление основывается на законах стехиометрии, в первую очередь, законе сохранения массы веществ в химических реакциях. Кроме уравнений используются полные и краткие схемы химических реакций — условные записи, дающие представление о природе реагентов и продуктов, то есть качественную информацию о химической реакции.
Зная закон сохранения массы, можно сформулировать правила составления химических уравнений:
1) необходимо знать формулы веществ, вступивших в реакцию (реагентов) и веществ, полученных в результате реакции (продуктов);
2) число атомов каждого элемента в левой части уравнения должно быть равно числу атомов этих же элементов в правой части уравнения;
3) нельзя переносить формулы веществ из одной части уравнения в другую.
Закон постоянства состава впервые сформулировал в 1808 г. французский учёный-химик Жозеф Луи Пруст.
Формулировка закона постоянства состава:
вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав.
Вещества с постоянным составом названы дальтонидами в честь английского химика Джона Дальтона.
Состав дальтонидов описывается химическими формулами с целыми стехиометрическими индексами, например `»H»_2″O»`, `»HCl»`, `»CH»_4`, `»CO»_2`, `»C»_2″H»_5″OH»`.
Из закона постоянства состава следует, что при образовании сложного вещества элементы простых веществ соединяются друг с другом в строго определенных массовых долях.
`omega_»э»` показывает, какую часть составляет масса данного элемента от массы всего вещества
где `n` – число атомов элемента в веществе;
`A_r` – относительная атомная масса элемента;
`M_r` – относительная молекулярная масса вещества.
Развитие химии показало, что наряду с веществами, имеющими постоянный состав, существуют вещества с переменным составом, который зависит от способа получения. Такие вещества назвали в честь французского химика Клода Бертолле – бертоллидами.
Бертоллиды не подчиняются законам стехиометрии. Примеры бертоллидов есть в классах оксидов, сульфидов, карбидов, гидридов.
Исходя из вышеизложенного, уточним формулировку закона постоянства состава: состав соединений с молекулярной структурой является постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой (с атомной, ионной и металлической решеткой) не является постоянным и зависит от условий получения.
постоянная масса
3.1 постоянная масса (соnstаnt mаss): Масса пробки после высушивания, когда разница между значениями двух последовательных взвешиваний составляет не более чем 10 мг.
3.3 постоянная масса (constant mass): Масса, достигнутая в процессе сушки, когда разница между двумя последовательными взвешиваниями пробы с интервалом в 4 ч между ними не превышает 0,1 % (в массовых долях) массы пробы, определенной при последнем взвешивании.
2.2 постоянная масса: Масса почвы, которая не изменяется между двумя последовательными взвешиваниями после высушивания в течение 4 ч более чем на 0,1 % (в массовых долях) от последней определенной массы анализируемой пробы.
Смотри также родственные термины:
3.4.52 постоянная масса бумаги или картона: Масса испытуемого образца бумаги или картона после сушки при стандартной температуре до тех пор, пока расхождение между двумя последовательными взвешиваниями образца не превысит 0,1 % от первоначальной массы испытуемого образца (ГОСТ 13525.19).
Полезное
Смотреть что такое «постоянная масса» в других словарях:
постоянная масса — pastovioji masė statusas T sritis Standartizacija ir metrologija apibrėžtis Bandinio masė, bandinį pakartotinai iškaitinus pasikeičianti ne daugiau kaip 0,0002 g. atitikmenys: angl. constant mass vok. konstante Masse, f rus. постоянная масса, f… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
постоянная масса — pastovioji masė statusas T sritis chemija apibrėžtis Bandinio ar mėginio masė, kuri, bandinį pakartotinai iškaitinus, pasikeičia ≤ 0,0002 g. atitikmenys: angl. constant mass rus. постоянная масса … Chemijos terminų aiškinamasis žodynas
постоянная масса — pastovioji masė statusas T sritis fizika atitikmenys: angl. constant mass vok. konstante Masse, f rus. постоянная масса, f pranc. masse constante, f … Fizikos terminų žodynas
постоянная масса бумаги или картона — 3.4.52 постоянная масса бумаги или картона: Масса испытуемого образца бумаги или картона после сушки при стандартной температуре до тех пор, пока расхождение между двумя последовательными взвешиваниями образца не превысит 0,1 % от первоначальной… … Словарь-справочник терминов нормативно-технической документации
МАССА — (лат. massa, букв. глыба, ком, кусок), физ. величина, одна из осн. хар к материи, определяющая её инерционные и гравитац. св ва. Понятие «М.» было введено в механику И. Ньютоном в определении импульса (кол ва движения) тела импульс р пропорц.… … Физическая энциклопедия
Постоянная Гельфонда — Постоянная Гельфонда трансцендентное число (то есть e в степени π). Названа в честь Александра Осиповича Гельфонда. Доказательство трансцендентности этого числа один из пунктов седьмой проблемы Гильберта. Содержание 1 Численное… … Википедия
Постоянная Гаусса — Постоянная Гаусса, или гравитационная постоянная Гаусса квадратный корень из гравитационной постоянной Ньютона G, выраженной в астрономической системе единиц (сутки, масса Солнца, астрономическая единица), одна из фундаментальных… … Википедия
Масса (физ. величина) — Масса, физическая величина, одна из основных характеристик материи, определяющая её инерционные и гравитационные свойства. Соответственно различают М. инертную и М. гравитационную (тяжёлую, тяготеющую). Понятие М. было введено в механику И.… … Большая советская энциклопедия
МАССА — (в обыденном представлении), количество вещества, заключающееся в данном теле; точное же определение вытекает из основных законов механики. Согласно второму закону Ньютона «изменение движения пропорционально действующей силе и имеет… … Большая медицинская энциклопедия
Молекулярная физика. Моль. Постоянная Авогадро. Количество вещества.
Моль — количество вещества, масса которого, выраженная в граммах, численно равна относительной атомной (молекулярной) массе.
Моль — единица количества вещества в СИ (одна из основных единиц СИ).
В 1 моле содержится столько молекул (атомов или других частиц вещества), сколько атомов содержится в 0,012 кг нуклида углерода 12 С с атомной массой 12.
Из этого определения следует, что в одном моле любого вещества содержится одно и то же число атомов или молекул.
Число это называется постоянной Авогадро и обозначается NA:
Постоянная Авогадро (число Авогадро) — это число атомов (молекул, или других структурных элементов вещества), содержащихся в 1 моле.
Постоянная Авогадро — одна из фундаментальных физических констант. Она входит в некоторые другие постоянные, например, в постоянную Больцмана.
Количество вещества.
Количество вещества — это число частиц вещества (атомов, молекул), выраженное в молях. Учитывая определение моля и числа Авогадро, можно сказать, что количество вещества v равно отношению числа молекул N в данном теле к постоянной Авогадро NA, т.е. к числу молекул в 1 моле вещества:

Урок 9. Молярная масса и молярный объем
В уроке 9 «Молярная масса и молярный объем» из курса «Химия для чайников» выясним, что подразумевается под молярной массой и молярным объемом; приведем формулы для их вычисления. Напоминаю, что в прошлом уроке «Химическое количество вещества и моль» мы выяснили, что такое химическое количество вещества; рассмотрели моль в качестве единицы количества вещества, а также познакомились с постоянной Авогадро.
Молярная масса
Вы знаете, что одинаковое химическое количество любых веществ содержит одно и то же число структурных единиц. Но у каждого вещества его структурная единица имеет собственную массу. Поэтому и массы одинаковых химических количеств различных веществ тоже будут различны.
Молярная масса — это масса порции вещества химическим количеством 1 моль.
В Международной системе единиц молярная масса выражается в кг/моль. В химии чаще используется дольная единица — г/моль.
Определим молярную массу углерода. Масса углерода химическим количеством 1 моль равна 0,012 кг, или 12 г. Отсюда:
Молярная масса любого вещества, если она выражена в г/моль, численно равна его относительной молекулярной (формульной) массе.
На рисунке 47 показаны образцы веществ (H2O, CaCO3, Zn), химическое количество которых одно и то же — 1 моль. Как видите, массы разных веществ химическим количеством 1 моль различны.
Молярная масса является важной характеристикой каждого отдельного вещества. Она отражает зависимость между массой и химическим количеством вещества. Зная одну из этих величин, можно определить вторую — массу по химическому количеству:
и, наоборот, химическое количество по массе:
а также число структурных единиц:
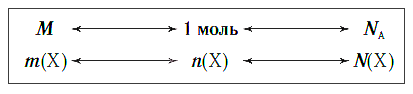
Взаимосвязь между этими тремя характеристиками вещества в любом его агрегатном состоянии можно выразить простой схемой:
Молярный объем
Подобно молярной массе, молярный объем газа равен отношению объема данного газообразного вещества V(Х) к его химическому количеству n(Х) :
Так как объем газа зависит от температуры и давления, то при проведении различных расчетов берутся обычно объемы газов при нормальных условиях (сокращенно — н. у.). За нормальные условия принимаются температура 0 °С и давление 101,325 кПа.
Установлено, что при нормальных условиях отношение объема любой порции газа к химическому количеству газа есть величина постоянная и равная 22,4 дм 3 /моль. Другими словами, молярный объем любого газа при нормальных условиях:
Пример 1. Вычислите химическое количество SiO2, масса которого равна 240 г.
Пример 2. Определите массу серной кислоты H2SO4, химическое количество которой 2,5 моль.
Пример 3. Сколько молекул CO2 и сколько атомов кислорода содержится в углекислом газе массой 110 г?
Пример 4. Какой объем занимает кислород химическим количеством 5 моль при нормальных условиях?
Краткие выводы урока:
Надеюсь урок 9 «Молярная масса и молярный объем» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Данный урок был заключительным в главе «Основные химические понятия».
Физика. 10 класс
§ 2. Масса и размеры молекул. Количество вещества
В 1,0 см 3 любого газа, находящегося при нормальных условиях (температура t0 = 0,0 °С, давление р0 = 1,0 · 10 5 Па), содержится 2,7 · 10 19 молекул. Чтобы представить, насколько велико это число, предположим, что из отверстия в ампуле вместимостью V = 1,0 см 3 ежесекундно вылетает 100 молекул. Тогда, для того чтобы все молекулы вылетели из ампулы, потребуется 8,6 млрд лет, т. е. промежуток времени, сравнимый с возрастом Вселенной (12–15 млрд лет). Такое огромное число молекул в веществе свидетельствует о том, что их размеры очень малы. Каковы же размеры и масса частиц вещества? Как определить число атомов в любом макроскопическом теле?
Молекулярно-кинетическая теория предоставляет возможность оценить массу и размеры частиц, образующих макроскопические тела. Молекулы, как и атомы, не имеют чётких границ. Если представить молекулу в виде шарика, то её радиус имеет значение от 0,1 нм у простейших до 100 нм у сложных молекул, состоящих из нескольких тысяч атомов. Например, оценочный диаметр молекулы водорода составляет 0,2 нм, а диаметр молекулы воды — 0,3 нм. При таких размерах число частиц в веществе очень велико. Например, в одном грамме воды содержится 3,3 · 10 22 молекул.
Размеры и масса молекулы возрастают с увеличением числа атомов, которые входят в её состав. Атомы и молекулы (кроме многоатомных молекул органических веществ) имеют массу порядка 10 –26 кг. Из-за малых значений выражать массы атомов и молекул в килограммах (кг) неудобно. Поэтому для измерения масс атомов и молекул в химии и физике используют атомную единицу массы (а. е. м.). Атомную единицу массы выражают через массу изотопа углерода :
Массу молекулы (или атома), выраженную в атомных единицах массы, называют относительной молекулярной массой Mr (или относительной атомной массой Ar). Относительная молекулярная (или атомная) масса Mr показывает, во сколько раз масса m0 молекулы (или атома) больше атомной единицы массы:
В периодической системе химических элементов Д. И. Менделеева (см. форзац 2) возле символов элементов указаны и их относительные атомные массы. В большинстве случаев при проведении расчётов значение относительной атомной массы округляют до целого числа, используя правила приближённых вычислений. Так, например, относительная атомная масса водорода равна 1, кислорода — 16, азота — 14.
Количество вещества, содержащегося в макроскопическом теле, определяют числом частиц в нём. Приведённые выше примеры показывают, насколько велико это число. Поэтому при расчётах принято использовать не абсолютное число частиц вещества, а относительное:
т. е. количество вещества ν определяют отношением числа частиц N этого вещества к постоянной Авогадро NA.
В молекулярно-кинетической теории наряду с относительной молекулярной (или атомной) массой используют м олярную массу M — массу вещества, взятого в количестве ν = 1 моль. Молярную массу M определяют отношением массы m вещества к его количеству ν:
Молярную массу вещества также можно вычислить по формуле
1. Во сколько раз число молекул водорода, взятого в количестве νв = 8 моль, больше числа молекул азота, количество вещества которого νа = 4 моль?
| Формула | Физические величины, входящие в формулу | Единицы физических величин |
| ν — количество вещества N — число частиц вещества NA — постоянная Авогадро | моль — моль –1 | |
| М — молярная масса | ||
| m — масса вещества m0 — масса молекулы вещества | кг кг | |
| NA = 6,022·10 23 моль –1 |
1. В каких единицах измеряют массы атомов и молекул?
2. Что такое количество вещества? Назовите единицу этой физической величины.
3. Что такое постоянная Авогадро?
4. Что называют молярной массой вещества?