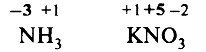что такое окислительные свойства в химии
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
К типичным окислителям относят:
Типичные восстановители – это, как правило:
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
Схема восстановления хроматов/бихроматов
Соединения хрома VI окисляют:
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Взаимодействие металлов с серной кислотой
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Пероксид водорода
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :
Периодический закон
Периодический закон был открыт Д.И. Менделеевым в 1868 году. Его современная формулировка: свойства химических элементов и образуемых ими соединений (простых и сложных) находятся в периодической зависимости от величины заряда атомного ядра.
Периодический закон лежит в основе современного учения о строении вещества. Периодическая система Д.И. Менделеева является наглядным отражением периодического закона.
Группой называют вертикальный ряд химических элементов в периодической таблице. Элементы собраны в группы на основе степени окисления в высшем оксиде. Каждая из восьми групп состоит из главной подгруппы (а) и побочной подгруппы (б).
Периодическая таблица Д.И. Менделеева содержит колоссальное число ответов на самые разные вопросы. При умелом ее использовании вы сможете предполагать строение и свойства веществ, успешно писать химические реакции и решать задачи.
Радиус атома
Радиусом атома называют расстояние между атомным ядром и самой дальней электронной орбиталью. Это не четкая, а условная граница, которая говорит о наиболее вероятном месте нахождения электрона.
В периоде радиус атома уменьшается с увеличением порядкового номера элементов («→» слева направо). Это связано с тем, что с увеличением номера группы увеличивается число электронов на внешнем уровне. Запомните, что для элементов главных подгрупп номер группы равен числу электронов на внешнем уровне.
С увеличением числа электронов они становятся более скученными, так как притягиваются друг к другу сильнее: это и есть причина маленького радиуса атома.
Чем меньше электронов, тем больше у них свободы и больше радиус атома, поэтому радиус увеличивается в периоде «←» справа налево.
Период, группа и электронная конфигурация
Правило составления электронной конфигурации, которое вы только что увидели, универсально. Если вы имеете дело с элементом главной подгруппы, то увидев номер группы вы знаете, сколько электронов у него на внешнем уровне. Посмотрев на период, знаете номер его внешнего уровня.
Длина связи
Убедимся в этом на наглядном примере, сравнив длину связей в четырех веществах: HF, HCl, HBr, HI.
Чем больше радиусы атомов, которые образуют химическую связь, тем больше между ними и длина связи. Радиус атома водорода неизменен во всех трех веществах, а в ряду F → Cl → Br → I происходит увеличение радиуса атома. Наибольшим радиусом обладает йод, поэтому самая длинная связь в молекуле HI.
Металлические и неметаллические свойства
Сравним металлические и неметаллические свойства Rb, Na, Al, S. Натрий, алюминий и сера находятся в одном периоде. Металлические свойства возрастают S → Al → Na. Натрий и рубидий находятся в одной группе, металлические свойства возрастают Na → Rb.
Основные и кислотные свойства
Замечу, что здесь есть одно важное исключение. Как и в общем случае: исключения только подтверждают правила. В ряду галогенводородных кислот HF → HCl → HBr → HI происходит усиление кислотных свойств (а не ослабление, как должно быть по логике нашего правила).
Восстановительные и окислительные свойства
Электроотрицательность (ЭО), энергия связи, ионизации и сродства к электрону
Для примера сравним ЭО-ость атомов Te, In, Al, P. Индий расположен в одной группе с алюминием, ЭО-ость In → Al возрастает (снизу вверх). Алюминий расположен в одном периоде с серой, ЭО-ость возрастает Al → S (слева направо). Сравнивая серу и теллур, мы видим, что сера расположена в группе выше теллура, значит и ее электроотрицательность тоже выше.
Энергия связи (а также ее прочность) возрастают с увеличением электроотрицательности атомов, образующих данную связь. Чем сильнее атом тянет на себя электроны (чем больше он ЭО-ый), тем прочнее получается связь, которую он образует.
Продемонстрирую на примере. Сравним энергию связи в трех молекулах: H2O, H2S, H2Se.
Высшие оксиды и летучие водородные соединения (ЛВС)
В периодической таблице Д.И. Менделеева ниже 7 периода находится строка, в которой для каждой группы указаны соответствующие высшие оксиды, ниже строка с летучими водородными соединениями.
Для элементов главных подгрупп начиная с IV группы (в большинстве случае) максимальная степень окисления (СО) определяется по номеру группы. К примеру, для серы (в VI группе) максимальная СО = +6, которую она проявляет в соединениях: H2SO4, SO3.
На экзамене строка с готовыми «высшими» оксидами, как в таблице наверху, может отсутствовать. Считаю важным подготовить вас к этому. Предположим, что эта строчка внезапно исчезла из таблицы, и вам нужно записать высшие оксиды для фосфора и углерода.
С летучими водородными соединениями (ЛВС) ситуация аналогичная: их может не быть в периодической таблице Д.И. Менделеева, которая попадется на экзамене. Я расскажу вам, как легко их запомнить.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Что такое окислительные свойства в химии
Ключевые слова конспекта: окислители, восстановители, окисление, восстановление.
Окисление – процесс отдачи электронов атомом, молекулой или ионом, степень окисления элемента повышается. Восстановление – процесс приёма электронов атомом, молекулой или ионом, степень окисления элемента понижается.
Окислители
Среди простых веществ окислительные свойства характерны для типичных неметаллов (F2, Cl2, Вг2, I2, O2, О3). Галогены, выступая в качестве окислителей, приобретают степень окисления –1, причём от фтора к йоду окислительные свойства ослабевают. Кислород, восстанавливаясь, приобретает степень окисления –2 (Н2O или ОН – ).
Концентрированная серная кислота проявляет окислительные свойства за счёт серы в высшей степени окисления +6. Продуктами восстановления серы могут быть: SO2 (степень окисления серы +4), сера – простое вещество (степень окисления серы 0), сероводород (степень окисления серы –2).
Азотная кислота проявляет окислительные свойства за счёт азота в высшей степени окисления +5, причём окислительная способность HNO3 усиливается с ростом её концентрации. Состав продуктов восстановления азотной кислоты зависит от активности восстановителя, концентрации кислоты и температуры системы; чем активнее восстановитель и ниже концентрация кислоты, тем глубже происходит восстановление азота.
Кислородсодержащие кислоты галогенов (например, HClO, HClO3, НВrO3) и их соли, действуя в качестве окислителей, обычно восстанавливаются до степени окисления галогена –1 (в случае хлора и брома) и 0 (в случае иода). Например:
5КСlO3 + 6Р = 5КCl + 3Р2O5
Водород в степени окисления +1 выступает как окислитель преимущественно в растворах кислот (как правило, при взаимодействии с металлами, расположенными в раду напряжений до водорода):
Zn + H2SO4 (разб.) = ZnSO4 + Н2↑
При взаимодействии с сильными восстановителями в качестве окислителя может проявлять себя и водород, входящий в состав воды:
2Н2O + 2Na = 2NaOH + Н2↑
Н2O + NaH = NaOH + Н2↑
Восстановители
Среди простых веществ к типичным восстановителям принадлежат активные металлы (щелочные и щёлочноземельные, алюминий, цинк, железо и др.), а также некоторые неметаллы, такие, как водород, углерод (в виде угля или кокса), фосфор, кремний. При этом в кислой среде металлы окисляются до положительно заряженных ионов.
Углерод чаще всего окисляется до монооксида СО или диоксида СO2; фосфор при действии сильных окислителей окисляется до ортофосфорной кислоты Н3РO4.
Образец выполнения задания ОГЭ.
Задание. Степень окисления азота в аммиаке и нитрате калия соответственно
1) –2 и +5
2) –3 и +5
3) +3 и +5
4) –4 и +3
Решение. Определим степени окисления элементов в аммиаке и нитрате натрия:
Обратим внимание, что в аммиаке степень окисления азота – отрицательная, так как электроотрицательность азота выше, чем электроотрицательность водорода.
Правильный ответ: 2) –3 и +5.
Конспект урока по химии «Окислители и восстановители».
Темы, связанные с настоящим конспектом: