что такое несущий ген s белка
Генетические варианты SARS-CoV-2: что они означают?
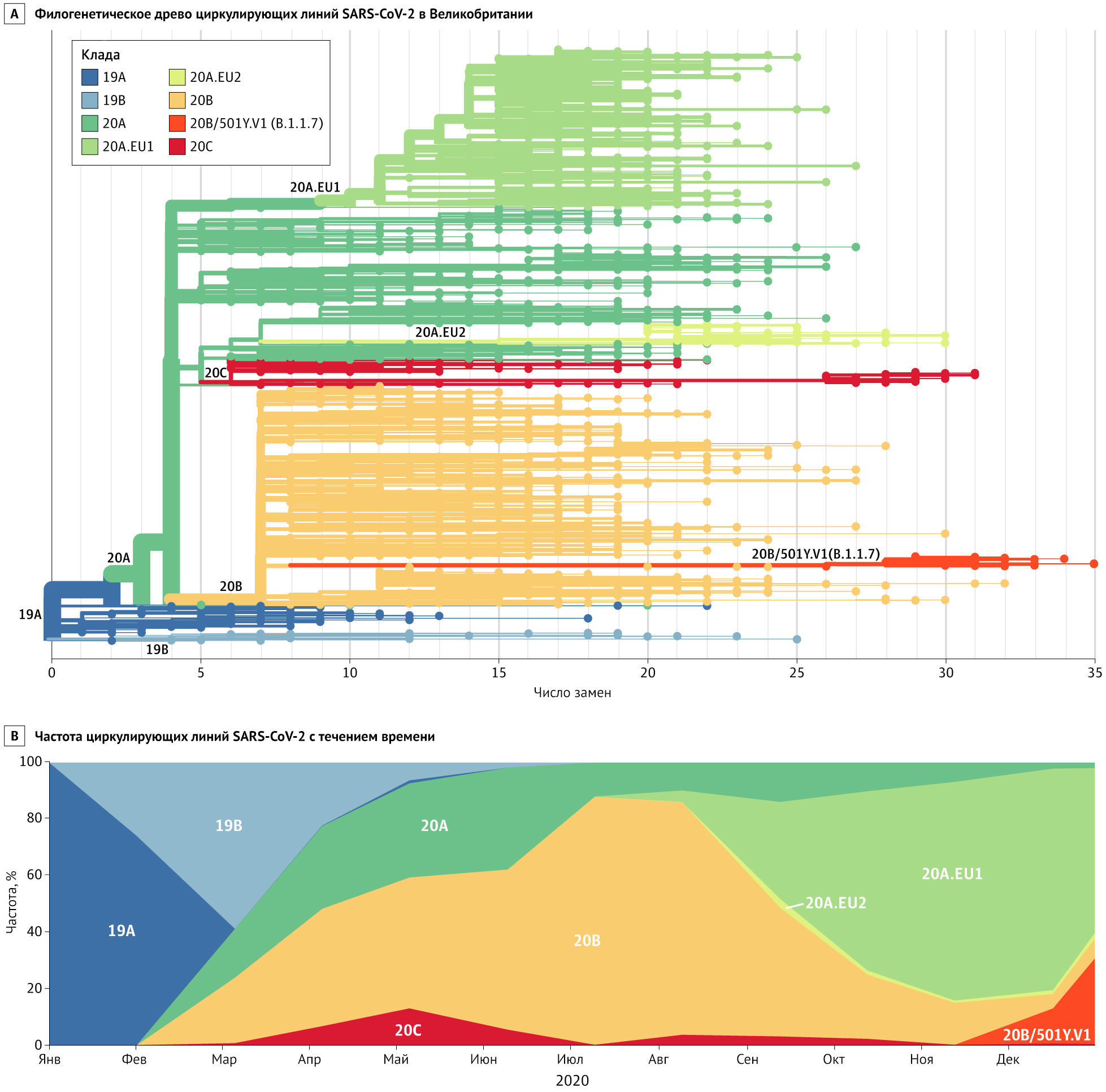
В ходе пандемии, вызванной коронавирусом тяжелого острого респираторного синдрома 2 (SARS-CoV-2), клинические и научные сообщества и системы общественного здравоохранения были вынуждены реагировать на новые генетические варианты вируса. Каждый новый вариант вызвал шквал внимания со стороны средств массовой информации, различные реакции научного сообщества и призывы правительств либо «сохранять спокойствие», либо принять немедленные контрмеры. Хотя многие ученые первоначально скептически относились к значимости мутации D614G, появление нового «британского варианта» — линии B.1.1.7 — вызвало широкую озабоченность. Чтобы понять, какие именно варианты вызывают обеспокоенность и почему, необходимо разобраться в эволюции вируса и геномной эпидемиологии SARS-CoV-2.
Дорогие коллеги, компания BestDoctor ищет среди наших подписчиков людей на позиции врача-консультанта, врача-куратора и врача-терапевта для онлайн-консультаций.
Мутации, варианты и распространение
Мутации возникают как естественный побочный продукт репликации вирусов [1]. Частота мутаций у РНК-вирусов обычно выше, чем у ДНК-вирусов. Однако у коронавирусов происходит меньше мутаций, чем у большинства других РНК-вирусов, потому что они кодируют фермент, который исправляет некоторые ошибки, возникающие во время репликации. Как правило, судьба вновь возникшей мутации определяется естественным отбором. Частота тех мутаций, которые дают вирусу конкурентное преимущество в отношении репликации, распространения или ухода от иммунитета, будет увеличиваться, а те, которые снижают приспособленность вируса, склонны отбраковываться из популяции циркулирующих вирусов. Однако частота мутаций также может увеличиваться и уменьшаться в результате случайных событий. Например, «эффект основателя» возникает, когда в ходе распространения ограниченное число отдельных вирусов создает новую популяцию. Мутации, присутствующие в геномах этих вирусов-предков, будут доминировать в популяции независимо от их влияния на приспособленность. Такое же взаимодействие естественного отбора и случайных событий формирует эволюцию вируса внутри хозяев, в различных сообществах и странах.
Хотя термины «мутация», «вариант» и «штамм» при описании эпидемиологии SARS-CoV-2 часто используются как взаимозаменяемые, важно понимать различия между ними. Термин «мутация» относится к фактическому изменению последовательности (ДНК или белка): D614G обозначает замену аспарагиновой кислоты на глицин в положении 614 гликопротеина шиповидных отростков (S-белка). Геномы, последовательности которых различаются, часто называют вариантами. Этот термин несколько менее точен, поскольку два варианта вируса могут отличаться одной или несколькими мутациями. Строго говоря, вариант — это штамм, обладающий явно отличающимся фенотипом (например, различиями в антигенности, трансмиссивности или вирулентности).
Оценка нового варианта SARS-CoV-2 должна включать в себя ответы на следующие вопросы: достиг ли вариант доминирующего положения в результате естественного отбора или случайных событий? Если имеющиеся данные свидетельствуют о естественном отборе, то какие мутации подверглись отбору? Каково адаптивное преимущество этих мутаций? Какое влияние эти мутации оказывают на трансмиссивность и распространение, антигенность или вирулентность?
Мутация D614G S-белка
Мутация D614G гликопротеина шиповидных отростков (S-белка) SARS-CoV-2 была впервые обнаружена на значительном уровне в начале марта 2020 года и в течение следующего месяца достигла глобального доминирования [2]. По-видимому, изначально мутация возникла независимо и одновременно распространилась по нескольким географическим регионам. Эта очевидная конвергентная эволюция наводит на мысль о естественном отборе и адаптивном преимуществе D614G. Однако при последующих секвенированиях мутация D614G была выявлена в вирусах, которые были распространены в нескольких китайских провинциях в конце января. Это свидетельствует в пользу того, что глобальное распространение этой мутации могло быть результатом случайных событий с «эффектом основателя», когда вирусы, несущие 614G, просто инициировали большинство ранних случаев передачи в нескольких местах.
Такая правдоподобная нулевая гипотеза заставила многих в эволюционном сообществе усомниться, что мутация D614G была адаптивной, несмотря на данные, полученные in vitro, которые показывают ее влияние на связывание с рецепторами. Недавний популяционно-генетический и филодинамический анализ более 25 000 последовательностей из Великобритании показал, что вирусы, несущие 614G, по-видимому, действительно распространяются быстрее и дают начало более крупным филогенетическим кластерам, чем вирусы, несущие 614D [3]. Величина эффекта в данном анализе была умеренной, и различные модели не всегда достигали статистической значимости. Совсем недавно дополнительное исследование на животных показало, что вирусы, несущие 614G, передаются более эффективно [4, 5].
Мутация N453Y S-белка и норки
Тревожные вспышки SARS-CoV-2 начали происходить на норковых фермах в Нидерландах и Дании в конце весны и начале лета 2020 года [6]. Геномные и эпидемиологические исследования ранней вспышки в Нидерландах показали передачу вируса от человека к норке, от норки к норке и от норки к человеку [7]. В начале ноября 2020 года датские власти сообщили о 214 случаях заболевания человека коронавирусной инфекцией (COVID-19), связанных с норковыми фермами. Многие последовательности SARS-CoV-2 в Нидерландах и Дании несли мутацию Y453F в рецептор-связывающем домене S-белка, которая может усиливать его способность связываться с АПФ2 (ангиотензинпревращающим ферментом 2) у норок. У одиннадцати человек, заразившихся во время датской вспышки, обнаружен вариант вируса под названием «кластер 5», несущий в гене S-белка три дополнительные мутации (del69_70, I692V и M1229I). Первоначальное исследование девяти образцов сыворотки выздоравливающих людей показало умеренное и статистически значимое снижение нейтрализующей активности антител против вирусов из кластера 5 (в среднем в 3,58 раза; диапазон 0–13,5). Очевидная адаптация SARS-CoV-2 к норке, тем не менее, вызывает беспокойство, поскольку продолжающаяся эволюция вируса в организме животных-носителей потенциально может привести к повторным передачам нового SARS-CoV-2 от норки к человеку и другим млекопитающим. По этой причине многие страны активизировали усилия по эпиднадзору и в некоторых случаях осуществили крупномасштабные выбраковки (то есть выборочный забой) норок на фермах.
Линия B.1.1.7 и мутация N501Y
Линия B.1.1.7 (также называемая 501Y.V1) представляет собой филогенетический кластер, который быстро распространяется на юго-востоке Англии [8] (Рисунок). До его обнаружения в начале сентября эта линия накопила 17 специфических мутаций, что свидетельствует о значительной предшествующей эволюции, возможно, в хронически инфицированном хозяине. По состоянию на 28 декабря 2020 года на этот вариант приходилось примерно 28 % случаев заражения SARS-CoV-2 в Англии, и популяционно-генетические модели позволяют предположить, что данная линия распространяется на 56 % быстрее других. В отличие от D614G, для которой, вероятно, могли быть выгодными ранние случайные события, линия B.1.1.7 распространилась, когда SARS-CoV-2 выявлялся уже повсеместно, и, по-видимому, достигла доминирующего положения, превзойдя существующую популяцию циркулирующих вариантов. Это убедительно говорит о естественном отборе вируса с большей трансмиссивностью на популяционном уровне. В то время как меры общественного здравоохранения, такие как маски, соблюдение дистанции и ограничение больших скоплений людей, должны оставаться эффективными, но борьба с более трансмиссивным («более заразным») вариантом, вероятно, потребует более строгого применения и повсеместного принятия этих мер.
Восемь мутаций линии B.1.1.7 затрагивают гликопротеин шиповидных отростков (S-белок), в числе которых N501Y в рецептор-связывающем домене, делеция 69_70 и P681H в сайте расщепления фурином. Все эти мутации могут влиять на связывание АПФ2 и репликацию вируса. Предполагается, что варианты с заменой 501Y в S-белке обладают более высоким сродством к АПФ2 человека. Другой вариант, также с мутацией N501Y, быстро распространяется в Южной Африке. Влияние этих мутаций на антигенность в настоящее время не ясно.
Иммуногенность и эффективность вакцины
Наблюдение за вариантами SARS-CoV-2 в основном сосредоточено на мутациях в гликопротеине шиповидных отростков (S-белке), который опосредует прикрепление к клеткам и является основной мишенью нейтрализующих антител. Существует большой интерес к тому, способствуют ли мутации в S-белке ускользанию от антител хозяина и могут ли они потенциально поставить под угрозу эффективность вакцин, поскольку в современных вакцинах именно S-белок является основным вирусным антигеном. На данном этапе строгий отбор вариантов на уровне популяции, вероятно, не обусловлен антителами хозяина, поскольку на данный момент нет достаточного количества иммунных индивидов для систематического продвижения эволюции вируса в каком-либо определенном направлении. Напротив, если у варианта в S-белке есть одна или несколько мутаций, повышающих трансмиссивность, он может быстро превзойти и вытеснить другие циркулирующие варианты. Поскольку современные вакцины вызывают иммунный ответ на весь S-белок, все еще есть надежда на эффективную защиту, несмотря на некоторые изменения в антигенных участках у различных вариантов SARS-CoV-2.
Разделение причины и следствия важно при оценке данных по нейтрализации антителами вариантов S-белка. Независимо от причины отбора мутации, разумно ожидать, что многие мутации в S-белке могут повлиять на нейтрализацию антителами. Поэтому важно учитывать как уровень изменения нейтрализации, так и количество проанализированных образцов сыворотки. Другая проблема заключается в том, что вирусные гликопротеины подвержены эволюционным компромиссам. Иногда мутация, усиливающая одно свойство вируса, например, связывание с рецептором, может ослабить другое свойство, такое как избегание антител хозяина. Действительно, недавние данные указывают на то, что это может иметь место в случае D614G [10]. Возможно, что мутации в S-белке, которые «полезны» для вируса прямо сейчас, также могут сделать его менее приспособленным к преодолению популяционного иммунитета в будущем. Определение этой динамики и ее потенциального влияния на эффективность вакцин потребует широкомасштабного мониторинга эволюции SARS-CoV-2 и иммунитета хозяина в течение длительного времени.
Человеческие антитела узнают разные коронавирусы
Наш иммунитет создаёт антитела, которые узнают сразу несколько видов особо патогенных коронавирусов – и, очевидно, могут узнать сразу несколько штаммов одного и того же коронавируса.
Когда к нам вторгается патогенный вирус или бактерия, иммунная система начинает синтезировать антитела – специальные белки, которые узнают патоген. Что значит узнают? Антитела связываются с молекулами, специфичными для микроба; в случае с вирусом такой молекулой будет какой-нибудь вирусный белок. Когда антитела прилипают к вирусному белку, то, во-первых, сам белок становится неспособен выполнять свои вредные функции, а во-вторых, иммунные клетки видят цель, помеченную антителами, и стараются её уничтожить.
Но антитела узнают не весь вирусный белок целиком, а лишь только его часть, небольшой структурный фрагмент. Вирусы же, как известно, достаточно легко мутируют. В вирусных белках появляются изменения, которые никак не мешают им работать и одновременно делают их невидимыми для антител. Конечно, потом иммунитет поймёт, что вирус от него ускользает, и у нас появится новая редакция антител – теперь они будут работать против нового штамма вируса. Но пока они не появились, этот штамм может причинить массу неприятностей. Опять же, если мы хотим создать вакцину против вируса, то приходится действовать с оглядкой на то, что вирус изменится, что у него появится новый вариант, и что прежняя вакцина окажется бесполезной.
В случае с новым коронавирусом SARS-CoV-2 большинство диагностических тестов и доступных вакцин ориентированы на так называемый S-белок. Он сидит в оболочке вируса и помогает ему проникнуть в клетку. Для вируса S-белок чрезвычайно важен, но при этом в S-белке легко появляются новые мутации, которые не мешают вирусу проникать в клетки. Соответственно, возникает вопрос, насколько эффективной будет вакцина, которая нацеливает иммунитет на S-белок. Конечно, здесь можно подумать о том, чтобы при создании вакцины учесть разные варианты S-белка, чтобы иммунная система могла узнать не какой-то один штамм, а сразу несколько штаммов вируса.
Но ведь кроме S-белка в вирусной оболочке есть и другие. Например, с РНК вируса, в которой хранятся все его гены, связан N-белок, или белок нуклеокапсида. Это белок-упаковщик, который помогает уложить РНК в компактную форму внутри вирусной частицы и одновременно защищает РНК от некоторых неблагоприятных воздействий. Сотрудники Университета штата Пенсильвания пишут в журнале Nanoscale, что N-белок на удивление постоянен среди разных видов коронавирусов. Исследователи сравнили аминокислотные последовательности и трёхмерные структуры N-белков вирусов SARS-CoV-2, SARS-CoV-1, MERS-CoV (который стал причиной вспышки весьма опасного ближневосточного острого респираторного синдрома в 2010-х). К человеческим коронавирусам добавили тех, что живут в летучих мышах, панголинах и циветтах – все эти животные служат естественным резервуаром коронавируса и именно от них, как считается, вирусы перепрыгивали к людям.
В вирусной частице N-белки скрыты в её глубине, под оболочкой, но при инфекции молекулы N-белков свободно плавают в крови, где их могут увидеть иммунные клетки; очевидно, N-белки также могут появиться на поверхности клеток, заражённых вирусом – клетки обычно выставляют на себе фрагменты белков, которые есть у них внутри, так что иммунитет может отличить больную клетку от здоровой. То есть иммунная система вполне способна создать антитела против N-белка, и она их действительно создаёт. N-белки разных вирусов мутируют, как и прочие вирусные белки, и в чём-то отличаются друг от друга. Но тот участок молекулы, за который их хватают антитела, у N-белков на удивление постоянен. То есть антитела против N-белка вируса SARS-CoV-2 могут узнать N-белок вируса MERS или вируса, взятого у панголина. Речь идёт именно о человеческих антителах: исследователи брали для эксперимента образцы крови больных COVID-19.
Здесь можно заметить, что авторы работы всё-таки не сравнивали N-белки разных штаммов коронавируса SARS-CoV-2. Однако если эти белки одинаковы у разных видов коронавирусов, то можно предположить, что у разных штаммов внутри одного и того же вида (то есть у разных штаммов SARS-CoV-2) они тем более будут одинаковы – в том смысле, что у них будут одинаковы те участки, за которые их хватают антитела. Если создать вакцину, после которой иммунитет будет узнавать именно N-белок, то с её помощью удастся защититься сразу от множества вирусных штаммов. Хотя, конечно, для надёжности всё равно нужно проверить, как выглядят N-белки у новых штаммов SARS-CoV-2, о которых в последнее время мы слышим всё чаще.
Новосибирские ученые развенчали все мифы о вакцинах от коронавируса
Новосибирские ученые ответили на самые популярные вопросы о вакцине от коронавируса. Они развенчали мифы, которые тиражируют ковидотрицатели и антипрививочники.
«Наука в Сибири» задала новосибирским ученым самые популярные вопросы о вакцинации. На них ответили завлабораторией биотехнологии факультета естественных наук Новосибирского госуниверситета Сергей Нетёсов, научный сотрудник лаборатории биотехнологии ФЕН НГУ и научный сотрудник университета Миннесоты в США Маргарита Романенко, старший научный сотрудник Института молекулярной и клеточной биологии Сибирского отделения РАН Сергей Кулемзин и научный сотрудник Института химической биологии и фундаментальной медицины СО РАН Сергей Седых.
Тайга.инфо перепечатывает материал коллег.
Почему мы так легко доверяем вакцине «Спутник V», которая разработана очень быстро и ещё не прошла полного цикла клинических испытаний?
Сергей Седых: Пандемия коронавирусной инфекции показала, что даже в XXI веке нет других способов контролировать вирусную инфекцию кроме карантина, вакцины и лекарств. Про карантин и масочный режим, в принципе, всё понятно. Разработка лекарственного препарата обычно занимает 5—10 лет. Начинается все с подбора органического вещества с предположительно терапевтическими свойствами. Далее идет стадия доклинических исследований, в которой анализируют токсичность, безопасность, терапевтический эффект сначала на культурах клеток, потом — на модельных животных. Затем три фазы клинических исследований. Все это очень долго и дорого, но это цена за безопасность и эффективность.
Разработать новый противовирусный препарат в течение одного года просто невозможно и не факт, что он будет эффективен против мутирующих штаммов вируса. Внести какое-то изменение в молекулу — значить начать новый цикл исследований. Поэтому закономерно, что разработчики новых вакцин в 2020 году оказались более востребованными.
С вакцинами от коронавирусной инфекции мы увидели, что платформенные решения (при которых вакцины против разных заболеваний создаются по единому принципу — Прим. ред.) — мРНК вакцины, аденовирусные, где используются технологии рекомбинантных ДНК, — самые перспективные. Они позволяют сделать новый продукт быстро и эффективно.
Более того, именно платформенность и возможность в течение нескольких дней немного изменить ген, кодирующий белок, и через пару месяцев получить новую версию вакцины с новым антигеном позволяют таким решениям эффективно бороться с новыми штаммами. Вакцина от гриппа каждый год содержит антигены новых штаммов вируса. Возможно, то же придётся делать и для вакцин против новой коронавирусной инфекции.
Коронавирусы были известны вирусологам очень давно. Относительно недавно два вируса SARS и MERS вызывали эпидемии, конечно, не такие масштабные, как SARS-CoV-2. Ученые были хорошо подготовлены, чтобы быстро сделать вакцины «нового поколения». Хотя нельзя сказать, что мРНК вакцины или аденовирусные вакцины — это последнее слово в вакцинологии, работы с этими платформами ведутся уже десятилетия.
Вакцина Гам-КОВИД-Вак («Спутник V») разработана очень быстро именно благодаря ее платформенности. В Национальном исследовательском центре эпидемиологии и микробиологии имени уже были сделаны прототипы вакцин на основе аденовирусов 5 и 26 типа, в них просто заменили один ген на ген S-белка SARS-CoV-2 и получили работающий продукт. В условиях «военного времени» не было возможности пройти полный цикл клинических исследований. Тем не менее, результаты были опубликованы в престижном журнале Lancet. Повторю, что работоспособность и безопасность этой аденовирусной конструкции давно доказана.
Отложенные побочные эффекты «Спутника V» не изучены, так как ещё не прошло достаточно времени. Какие побочные эффекты бывают у векторных вакцин?
Сергей Седых: До середины 2020 года ни одна из аденовирусных вакцин не была разрешена для использования, хотя потенциал применения аденовирусов для генной терапии был показан еще в 1990-е годы. В основном в качестве векторов берут аденовирусы человека 5 и 26 серотипа («Спутник V» и «Johnson & Johnson»), в вакцине «AstraZeneca» использован аденовирус шимпанзе.
Аденовирусы человека могут вызывать ОРВИ, гастроэнтериты, конъюнктивит и другие инфекции. Однако вирус, используемый в вакцине, не способен к репликации в клетках человека. Он не содержит фрагментов генома, необходимых для размножения (эти гены есть в культуре клеток, в которых его нарабатывают). Зато после вакцинации в организме человека работает ген S-белка, встроенный в аденовирус. В результате синтезируется белок, необходимый для выработки нейтрализующих антител и защиты от коронавируса.
Природные аденовирусы размножаются в верхних дыхательных путях и кишечнике. Вакцинация проводится путем инъекции в мышцу, в которой аденовирус размножаться в принципе не способен. Таким образом, вирус, используемый в вакцине, не может вызывать ОРВИ и кишечные расстройства.
Но даже введение в мышцу вызывает у некоторых людей достаточно выраженную реакцию (сильную головную боль, температуру, слабость в течение нескольких дней). Пока трудно сказать, сказывается ли она положительно на иммунном ответе и выработке антител. Мы видели хорошие титры антител и у тех доноров крови, которые тяжело перенесли вакцинацию, и у тех, кто «почти ничего не заметил».
Надо сказать, что мРНК-вакцины (к которым относятся «Pfizer» и «Moderna») представляют собой матрицу для синтеза белка в липидной оболочке, то есть похожи на вирус только отдаленно. Хотя мРНК-вакцины не содержат на своей поверхности вирусных белков, они тоже часто вызывают у вакцинированных повышение температуры и плохое самочувствие. Есть мнение, что наработка антител в организме в принципе должна сопровождаться такой реакцией.
Сказать, что никаких отдаленных побочных эффектов у векторных вакцин нет и точно быть не может, на сегодняшний день нельзя. Однако такие способы иммунизации давно известны ученым и были достаточно подробно изучены, правда, в основном на лабораторных животных.
Получается, что мы все участвуем в большом эксперименте, но цена, которую мы за это платим, несопоставима с пользой. Известно, что среди тысяч пациентов ковидных отделений и палат интенсивной терапии единицы получили вакцину от коронавирусной инфекции. Вакцинация аденовирусными и мРНК-вакцинами уже спасла миллионы жизней и спасет еще больше, когда человечеству удастся справиться с пандемией. А это, как мы видим, невозможно без прививок.
Сергей Нетёсов: Все люди за свою жизнь неоднократно сталкиваются с десятками вирусов, включая коронавирусы четырех видов и аденовирусы самых разных серотипов, но мало кто задумывается о последствиях.
В вакцине Спутник V присутствуют дефектные рекомбинантные аденовирусы 26-го и 5-го серотипов, которые не могут размножаться в человеческих клетках. Таким образом, опасаться долговременных последствий не стоит, хотя для страховки эта вероятность на всякий случай изучается в рамках третьей фазы испытаний на добровольцах. Уточню, что она изучается, но не предполагается. Более чем у 70% людей старше 40 лет выявляются антитела к аденовирусу 5-го серотипа и к целому ряду других аденовирусов, которые они уже перенесли за свою жизнь.
Может ли вакцина (в частности, векторная) повлиять на геном и серьёзно изменить ДНК вакцинированного?
Маргарита Романенко: Краткий ответ: нет, не может. Никакая из тех, которые у нас сейчас есть. Мы не будем останавливаться на РНК-вакцинах «Pfizer» и «Moderna», потому что они в России не представлены, и сосредоточимся на аденовирусных, к которым относится и «Спутник V».
Надо сказать, что внести в клетку чужеродную ДНК не так-то просто. В клетке всё чётко упорядочено, и против чужой нуклеиновой кислоты предусмотрены специальные охранные меры. Поэтому некоторые семейства вирусов в ходе эволюции разработали специальные механизмы и белки, позволяющие разрезать человеческую хромосому, встроить туда свою ДНК и сшить. Самый яркий пример подобного вируса, это, конечно же, ВИЧ.
Аденовирусы по своей природе не могут встраиваться в ДНК человека, поскольку у них нет таких ферментов. В том числе поэтому они и были взяты в качестве основы для векторных вакцин. Прививка на основе аденовируса не может ни серьезно, ни слегка повлиять на ДНК, это абсолютно исключено. Работы с аденовирусами ведутся уже более 30 лет, их всесторонне изучили и применяют на людях уже более 20 лет. Учёные никогда не наблюдали их встройки в геном ни напрямую, ни по косвенным признакам.
Может ли вакцина повлиять на геном будущих детей (при условии, что они были зачаты через несколько месяцев или лет после неё)?
Маргарита Романенко: Чтобы повлиять на будущих детей, нужно чтобы какая-то чужая ДНК выстроилась в яйцеклетки или сперматозоиды.
Этого с вакцинами не происходит. Во-первых, потому что ДНК аденовируса не может встраиваться в наш геном ни в каких клетках. Во-вторых, аденовирусы попросту не доходят ни до семенников, ни до яичников, поскольку их нахождение ограничено только местом введения вакцины. Это мышцы и соседний лимфатический узел, в котором будет производиться вся последующая иммунологическая работа. Именно там сидят многие наши иммунные клетки. Поэтому при вакцинации вирус или его части доставляются туда, чтобы лимфоциты узнали патоген и выработали против него защиту.
Теоретически, при внутримышечной инъекции небольшая часть вируса может попадать в кровь. Но у человека, как и у всех млекопитающих, эволюция давно разработала специальную систему для избавления от всего лишнего в кровотоке. Эта система называется ретикулоэндотелиальной. В неё входят макрофаги, расположенные в разных органах, — они выхватывают из крови различные патогены и быстро их «переваривают», блокируя дальнейшее распространение. Особенно много таких клеток в печени, есть они и в селезенке, легких, других органах.
Даже введенный внутривенно, аденовирус не оказывает на организм никакого негативного воздействия. Так, существует специализированное лечение онкологии, основанное на внутривенном введении вируса. По всему миру тысячи человек получили инъекции больших доз аденовируса, но никаких опасных последствий учёные не обнаружили. Здесь захват клетками-чистильщиками только мешал терапевтическому эффекту.
Не важно — до или после зачатия сделана вакцина, это никак не повлияет на будущих детей. Если вы поставили прививку и обнаружили, что беременны, не стоит переживать и делать аборт. Наоборот, нужно радоваться, что теперь коронавирус если и угрожает вам, то только в легкой форме.
Может ли вакцина вызвать бесплодие?
Маргарита Романенко: Чтобы что-то приводило к бесплодию, оно должно поражать семенники или яичники. Например, есть респираторный вирус, вызывающий паротит (свинку). Он действительно влияет на эпителий семенников, что приводит к мужскому бесплодию.
Недавно я видела исследования, в которых показано, что, похоже, в семенниках может размножаться и коронавирус. Поэтому если вы боитесь бесплодия, то скорее стоит опасаться коронавируса, чем вакцины.
Вакцина не размножается в половых органах, не умеет встраиваться в геном, не влияет ни на какие системы организма таким образом, чтобы это вызывало бесплодие. Не затрагивает она и гормональную систему. Ведь чтобы воздействовать на последнюю, нужно, чтобы вирус поразил какие-то клетки, отключение которых потом повлечёт за собой гормональную перестройку у женщины или физическое повреждение половых клеток.
Даже дикие не модифицированные аденовирусы никогда не приводят к бесплодию. А вакцинный штамм сделан таким образом, что он вообще не способен размножаться в клетках человека. Аденовирус не поражает никакие из клеток, которые хоть как-то могли бы повлиять на зачатие, ни в женском, ни в мужском организме.
Может ли на компоненты вакцины внезапно развиться сильная аллергия?
Сергей Седых: Аллергия, как правило, развивается при повторной встрече с аллергеном. Известно, что лицам с выраженной аллергией на куриный белок, противопоказаны определенные вакцины от гриппа, клещевого энцефалита и некоторых других болезней. Если мы говорим о вакцинах против коронавирусной инфекции, такая реакция маловероятна.
Если у пациента после вакцинирования возникла сильная аллергическая реакция, ему противопоказано введение второго компонента. Например, если такое произошло после введения «Спутника V», лучше продолжить вакцинацию КовиВаком, в таком случае подобная реакция менее вероятна.
Стоит ли вакцинироваться аллергикам? Этот вопрос лучше задать квалифицированному лечащему врачу, но давайте подумаем, хорошо ли аллергику переболеть COVID-19? Это же справедливо для лиц с хроническими заболеваниями, беременных и кормящих женщин. Сегодня мы видим, что в России и других странах спектр лиц, которым рекомендована вакцинация, значительно расширен (по сравнению с тем, что было в начале 2021 года). Осторожное использование вакцины «Спутник V» в группах риска показало ее безопасность.
Тем не менее, вакцина действительно новая, нельзя исключить, что мы чего-то не знаем про нее. И именно поэтому всем вакцинированным рекомендуют 30 минут не покидать пункт вакцинации, чтобы врачи смогли оказать квалифицированную помощь, если вдруг что-то пойдет не так.
Насколько безопасна вакцина для пожилых людей? Ведь в первые дни после прививки возможны достаточно сильные побочные эффекты.
Сергей Кулемзин: Исследования показывают, что чем старше человек, тем легче переносится иммунизация вакцинами против SARS-CoV-2 на основе аденовирусных векторов (к таким относится «Спутник V»). У людей старшей возрастной группы побочных эффектов чаще всего нет никаких. Естественно, риски остаются, однако пользы несравнимо больше, особенно для пожилых людей.
Почему у некоторых людей после вакцинации не нарабатываются антитела (возможно ли такое, или это ошибка тестов на антитела)? Всегда ли антитела вырабатываются после болезни?
Сергей Кулемзин: Описаны нечастые случаи, когда заболевание COVID-19 или иммунизация не вызывает выработку антител. Это не ошибка тестов, а особенность формирования иммунного ответа для конкретного человека. Иногда у таких людей может присутствовать специфический Т-клеточный ответ, то есть они в какой-то степени будут защищены от инфекции.
Сейчас нет клинических рекомендаций для людей, у которых вакцинация не привела к индукции антител. Однако уже есть сообщения, что иммунизация по схеме: первая инъекция векторной; вторая — мРНК вакциной, приводит к очень хорошему иммунному ответу. Возможно в ближайшей перспективе иммунизация разными типами вакцин будет распространена для достижения наилучших результатов.
Почему некоторые люди заболевают коронавирусом после вакцинации? Значит ли это, что вакцина нерабочая?
Сергей Кулемзин: Эффективность наиболее распространенной в России вакцины «Спутник V» была исследована в обширных испытаниях и составляет более 91%. Это значит, что некоторые люди все-таки могут заболеть после вакцинации, однако вероятность этого для вакцинированных сильно ниже, чем для не привитых. Более того, если привитый человек заразится, болезнь чаще всего протекает в легкой форме.
Появляющиеся варианты вируса SARS-CoV-2 (в том числе индийский вариант) несколько отличаются от Уханьского штамма, S-белок которого был взят за основу для разработки большинства вакцин. В связи с этим, вероятнее всего, эффективность имеющихся прививок против новых вариантов будет снижена, однако иммунная система привитых людей все равно в значительной степени готова к борьбе с мутантным вирусом.
Существует мнение, что второй компонент «Спутника V» переносится тяжелее. Правда ли это?
Сергей Нетёсов: Второй компонент «Спутника V» основан на аденовирусе 5-го серотипа (Ад5), который встречается среди аденовирусных ОРВИ наиболее часто. Люди чаще всего инфицируются им уже в первые годы жизни. В китайской провинции Цинхай, например, 70% детей с 10 лет и старше имеют к нему антитела, да и в других странах цифры похожие.
Разумеется, в случае заражения Ад5 никто не делает диагностику, потому что это легкое ОРЗ (острое респираторное заболевание). Поэтому тяжелая реакция на вторую прививку Спутником встречается крайне редко. Все поствакцинальные реакции и побочные эффекты указаны в инструкции по применению вакцины «Спутник V», которую легко найти на обще-фармацевтических сайтах, например, здесь.
Может ли привитый человек быть заразным для окружающих?
Сергей Нетёсов: Это не исключено в том случае, если он заразится коронавирусом после прививки. Сама прививка не содержит коронавируса. Поэтому привитый человек, сам не зараженный коронавирусом, не может заразить других людей. Тем более, что оба компонента вакцины «Спутник V» не могут размножаться в человеческом организме. Дело в том, что у содержащихся в вакцине аденовирусов 26-го и 5-го серотипов убрана часть генов, которые ответственны за размножение в нормальных клетках человека. Не исключено, что заразившийся коронавирусом после прививки человек может выделять вирус, но это количество будет незначительным.
Люди опасаются отложенных эффектов вакцины. А насколько изучены отложенные эффекты самого коронавируса?
Сергей Нетёсов: Отложенные эффекты от заболевания самого коронавируса изучаются. Однако, он циркулирует всего лишь полтора года, поэтому мы можем основываться только на данном периоде. Уже отмечены такие возможные осложнения, как головная боль в течение нескольких месяцев после перенесенной инфекции, ослабевание умственных способностей, астения — слабость в мышцах, и другие. Это наблюдается не у всех переболевших, но у многих, и у некоторых эти эффекты продолжаются долго и проходят в тяжелых формах. И, конечно же, они намного более серьезные, чем кратковременные побочные эффекты от вакцины.